





Comparaison
expérimentale du système à lit de sable
et du système à plénum
par Robert J. Toonen
Hawaii Institute of Marine Biology,
School of Ocean & Earth Science & Technology,
University of Hawaii at Manoa, P.O. Box 1346, Kaneohe, HI 96744, USA
Historique
et introduction :
Le syst?me bas? sur le principe
du pl?num a acquis sa notori?t? apr?s que le Prof. Jean Jaubert l'a appliqu?
? l'aquarium de Monaco en y transportant une partie compl?te vivante d'un
r?cif de coraux de la Mer Rouge pour l'exposer ? Monaco. Le Dr. Jaubert
a beaucoup travaill? avec des substrats coralliens collect?s dans la nature
pour augmenter la filtration biologique dans les aquariums clos et a obtenu
un brevet fran?ais pour la conception du pl?num ? la fin des ann?es 80,
suivi d'un brevet am?ricain en 1991. Bas? en grande partie sur le succ?s
du "Microcean" de l'aquarium de Monaco, cet aquarium con?u sur le syst?me
du pl?num est devenu l'une des premi?res m?thodes con?ue utilis?e par
des aquariums publics dans le monde entier et il y a une bonne d?cennie elle
a presque eu une popularit? identique parmi les aquariophiles amateurs.
Cependant, au cours des derni?res ann?es le concept des " lits de sable
?pais " a largement remplac? parmi les amateurs am?ricains les syst?mes
bas?s sur le pl?num. La confiance sur un lit ?pais de d?p?ts de carbonates
est essentiellement la m?me que celle du syst?me bas? sur le pl?num, mais
l'utilit? de l'espace vide en dessous de ces d?p?ts a ?t? s?rieusement
contest?e. Les avocats des lits de sable ?pais soutiennent que c'est le
substrat lui-m?me et non la pr?sence d'un espace vide sous ces d?p?ts
qui est capable de la transformation des nutriments (e.g., Toonen 2000a, 2000b).
De nombreux articles et livres ont ?t? ?crits dans le hobby aquariophile
? propos des avantages et des inconv?nients de conception pour chacun de
ces deux syst?mes de recirculation (e.g., Adey & Loveland 1991, Tullock 1997,
Auger 1999, Goemans 1999, Shimek 2001, Hovanec 2003, Delbeek & Sprung, sous
presse). Il subsiste d'importants d?bats concernant la conception du lit
de substrats le plus efficace pour la transformation des nutriments dans un
syst?me de recirculation. Mais ? ce jour ces arguments ont ?t? presque
enti?rement bas?s sur une opinion personnelle et un t?moignage anecdotique.
Malgr? la diversit? des opinions concernant ce sujet, pratiquement tous
les aquariums publics continuent ? suivre la conception du bac bas? sur
le pl?num. Parmi les amateurs les syst?mes berlinois et le syst?me Jaubert
semblent ?tre les concepts les plus couramment utilis?s en Europe et le
syst?me du lit de sable a tendance ? ?tre plus populaire aux USA. De m?me
la granulom?trie id?ale du substrat, l'?paisseur du lit de substrat et
la pr?sence d'un vide en dessous du lit de substrat sont chaudement discut?s
dans la litt?rature populaire (v?rifi? par Toonen 2000a, b). Cependant,
il n'y a jamais eu d'exp?rimentation comparative de faite pour d?terminer
si la pr?sence ou l'absence d'un vide en dessous des substrats conf?rait
un avantage par rapport ? la pr?sence des substrats eux-m?mes. En d?pit
de l'utilit? largement r?pandue de ces m?thodes par les instituts acad?miques,
les mus?ums et les amateurs ? ce jour il n'y a pas eu de test syst?matique
par rapport ? la capacit? de traitement des nutriments dans les aquarium
bas?s sur les syst?mes ? lit de sable face au pl?num. Nous allons examiner
la contribution d'un espace vide (lit de sable avec ou sans pl?num), l'?paisseur
du s?diment (2.5 versus 9.0 cm), et la taille moyenne des grains du substrat
(2.0 versus 0.2 mm diam?tre moyen des grains) dans les aquariums par rapport
? leur capacit? de transformation des nutriments et leur performance comme
seule m?thode de filtration pour les aquariums ? recirculation.
M?thodes et mat?riaux d'exp?rimentation :
a.) Aquarium d'exp?rimentation
Nous avons install? une exp?rimentation de conception factorielle avec trois
bacs dupliqu?s (longueur 27 cm x largeur 17 cm x hauteur 30 cm) pour chaque
facteur : avec ou sans pl?num, ?pais ou mince et substrats fins ou grossiers
pour un total de 24 aquariums exp?rimentaux (Fig. 1). L'exp?rimentation
compl?te a ?t? men?e dans une pi?ce ? temp?rature contr?l?e ? 25?
C maintenue dans le noir sauf un unique tube fluorescent seulement allum?
lors des op?rations de tests de l'eau. Les protocoles ?taient assign?s
aux aquariums par l'utilisation d'un g?n?rateur de nombre al?atoire; si
un aquarium ?tait d?j? assign? pour un protocole pr?c?dent, un autre
nombre al?atoire ?tait tir? jusqu'? ce que toutes les protocoles aient
?t? assign?s ? un aquarium individuel.
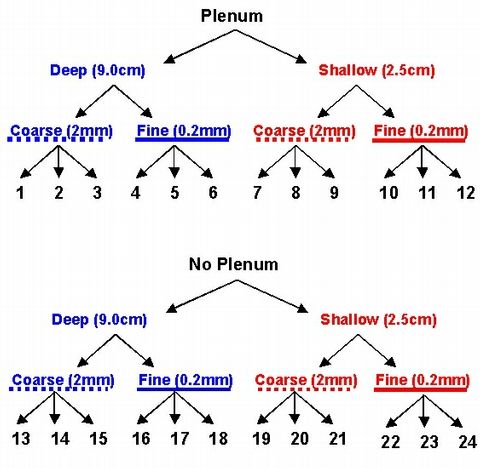
Figure 1a: Sch?ma de la conception d'un aquarium destin? ? comparer directement
les r?sultats de la pr?sence
ou de l'absence d'un pl?num, de l'?paisseur du lit de sable et de la taille
moyenne des grains du substrat dans
un aquarium ? recirculation.

Figure 1b: Photographie des aquariums utilisés lors de cette expérimentation.
Aucun protocole avec pl?num n'avait de substrats d?pos?s sur le fond de
l'aquarium. Les protocoles avec pl?num avaient des substrats suspendus sur
une plaque faite d'un fin voile de nylon fix? ? l'aide de colle thermique
? une grille de diffusion de lumi?re ? claire-voie d'un cm d'?paisseur.
Cette plaque est suspendue ? 1,5 cm du fond du bac par cinq anneaux (en PVC
d'un diam?tre de ?" ID) fix?s par de la colle thermique quatre r?partis
? chaque coin et un au centre. Les substrats humides ont ?t? d?licatement
d?pos?s sur la plaque avant l'addition de l'eau aux aquariums afin de minimiser
toute percolation de substrats ? travers le filet de nylon vers l'espace
vide du pl?num.
Les protocoles avec substrats ?pais contenaient 9 litres de substrat humide
pour fournir une ?paisseur constante d'environ 9 cm. Les protocoles avec
substrats peu ?pais contenaient 2,5 litres de substrat humide afin de fournir
une ?paisseur constante d'environ 2,5 cm. Du corail concass? Geo-Marine
Florida (surtout allong?, en moyenne 2 x 4 mm, avec un diam?tre moyen de
grains de ~ 2.0 mm) a ?t? utilis? pour le substrat grossier et du sable
" Southdown Tropical Play Sand " (diam?tre moyen des grains ~ 0.2 mm) a ?t?
utilis? pour le substrat fin. 25 kilos de chaque ont ?t? achet?s chez
un commer?ant et pass?s en autoclave avant utilisation. Du substrat autoclav?
de chaque type a ?t? plac? dans des containers s?par?s maintenus dans
un grand aquarium de stockage. Le bac de stockage a ?t? rempli avec ~ 400
litres d'eau de mer naturelle filtr?e ? 2.0 ?m et 30ml de calamar surgel?
homog?n?is? (Loligo sp.) ont ?t? ajout?s comme source de nutriments
pour la croissance des bact?ries sur les substrats st?riles. Les substrats
ont ?t? bien m?lang?s ? la main tous les deux jours durant huit semaines
jusqu'? ce que la quantit? d'ammoniaque soit devenue ind?tectable dans
l'aquarium de stockage.
Apr?s que les protocoles avec substrats aient ?t? plac?s dans chaque bac,
8 litres d'eau de mer naturelle filtr?e ? 2.0 ?m ont ?t? vers?s en goutte
? goutte dans chaque aquarium afin d'?viter toute alt?ration du lit de
substrat. L'eau circule dans les aquariums par l'utilisation d'une pompe Catalina
Aquariums CAP-180 r?gl?e ? 50 % de son d?bit (environ 190 l/h) plac?e
au bout de chaque aquarium de fa?on ? ce que le sommet de la pompe soit
? la m?me hauteur que la surface de l'eau de l'aquarium. 3M chlorure d'ammonium
(NH4Cl) (3 molar (3M) signifie 3 fois le poids mol?culaire du
compos? par litre d'eau. Dans ce cas, le poids mol?culaire du chlorure d'ammonium
est de 53.49, donc 3M ?quivalent ? 3 x 53.49 (ou 160.47) g / l a ?t? ajout?
? chaque bac les jours suivants pour atteindre une concentration finale de
8 mg NH4+
/ l 21 jours apr?s la dose initiale de 8 mg NH4+
/ l, dosage continu? avec 3M NH4Cl
au taux de 0.5 mg / l / jour.
Comme je r?alise que ces nombres ne signifient pas grand chose pour la plupart
des amateurs, je vais le placer dans le contexte de la charge biologique.
Les poissons lib?rent une moyenne de ~ 0.5 ? 0.1 ?M ammoniaque / g / h,
et un Zebrasoma flavescens de 7,5 cm p?se environ 10.5 ? 2.2 g. Ainsi
notre addition de 0.5 mg / l/ jour dans un bac de 9 litres ?quivaut ? deux
chirurgiens jaunes adultes dans moins de 12 litres ! La plupart des aquariums
r?cifaux bien peupl?s produisent moins de 0.5 mg NH4+
/ l / jour et un syst?me d'aquaculture charg? g?n?re 0.6 - 2.0 mg NH4+
/ l par jour (Tseng & Wu 2004).
Apr?s la p?riode de rodage initiale, l'exp?rimentation a ?t? poursuivie
durant 111 jours suppl?mentaires sans aucun changement d'eau. Pour compenser
l'?vaporation des bacs exp?rimentaux, de l'eau d?ionis?e distill?e a
?t? ajout?e afin de r?duire la salinit? ? ~ 53 mS apr?s chaque p?riode
de test.
b.) Exp?rimentation sur des
aquariums avec animaux vivants
Trois bacs dupliqu?s pour chaque facteur ont ?t? exactement install?s
dans la configuration cit?e plus haut (Fig. 1). Les substrats des exp?rimentations
pr?c?dentes ont ?t? retir?s de chaque bac et associ?s ensembles avec
un volume ?gal de substrat naturel de granulom?trie approximativement identique
r?colt? dans le lagon de Coconut Island (Hawaii Institute of Marine Biology,
Kaneohe, HI). Ces substrats, avec l'endofaune naturelle, ont ?t? soigneusement
m?lang?s manuellement puis redistribu?s parmi les aquariums comme d?taill?
plus haut. Les aquariums ont ?t? plac?s ? l'ext?rieur dans une annexe
ombrag?e fin de les prot?ger de la pluie et du soleil direct. La temp?rature
et l'?clairage fluctuent en fonction des conditions naturelles. L'eau circule
par l'interm?diaire d'une pompe CAP-180 comme d?crit pour les exp?rimentations
pr?c?dentes de dosage. Les bacs ont eu la possibilit? de se stabiliser
durant une semaine sans addition de nutriments avant l'introduction des animaux
vivants. Les param?tres de l'eau ont ?t? test?s pour chaque aquarium ?
la fin de cette semaine afin de d?terminer les conditions de d?marrage pour
chaque aquarium d'essai.
Apr?s la premi?re semaine de stabilisation nous avons ajout? 1 kilo de
pierres vivantes (consistant en 1 ? 3 pi?ces de d?bris naturels de coraux
r?colt?es sur la proche c?te), un poisson-coffre (Canthigaster jactator),
un petit oursin (Echinometra oblongata), 10 bernard l'ermite (Calcinus
laevimanus) et 10 escargots (5 Littorina sp. et 5 Nerita sp.)
dans chaque aquarium. Les poissons sont nourris avec des boulettes de calmar
(Loligo sp.) ad libitum tous les jours (sauf les week-end) jusqu'?
ce qu'ils n'ing?rent plus la derni?re boulette offerte. La derni?re boulette
non consomm?e est laiss?e dans l'aquarium pour fournir de la nourriture
aux d?tritivores du bac. Le nombre de boulettes peut donc changer chaque
jour et de bac ? bac. Le nombre final de boulettes distribu? ? chaque bac
?tait diff?rent ? la fin de l'exp?rience. Toutefois au cours de l'exp?rimentation
globale il n'y avait pas de diff?rences significatives dans le nombre de
boulettes distribu?es au cours d'une op?ration. Tout d?c?s d'animal dans
les aquariums ?tait not? lors de chaque p?riode de test et les animaux
de remplacement ajout?s si n?cessaires pour maintenir une charge biologique
constante de chaque protocole durant la p?riode exp?rimentale. Apr?s la
p?riode initiale de rodage, l'exp?rience ?tait poursuivie durant 118 jours
apr?s l'ajout des animaux vivants sans aucun changement d'eau. De nouveau,
la salinit? de chaque aquarium ?tait ajust?e ? ~ 53 mS tous les deux jours.
c.) Contr?le de l'eau des aquariums
Tous les bacs ont ?t? rempli au d?part ? partir du grand bac de stockage
d'un m?lange d'eau de mer naturelle bien m?lang?e. Un ?chantillon unique
de 50 ml de cette eau a ?t? r?colt?e et congel?e ? - 80? C ? des fins
d'analyse. De plus un ?chantillon unique de 50 ml de chaque aquarium a ?t?
r?colt? le 111 ?me jour de l'exp?rimentation de dosage et le 118 ?me
de celle avec les animaux vivants et ?galement congel? ? - 80? C. A la
fin de l'exp?rimentation, tous les ?chantillons d'eau ont ?t? transport?s
congel?s ? l'universit? de Hawaii ? Manoa et les concentrations de nutriments
dans l'eau ont ?t? d?termin?s en utilisant des m?thodes colorim?triques
sur un ''Technicon AutoAnalyzer'' comme signal? dans Laws et al. (1999).
Chaque aquarium exp?rimental a ?galement ?t? contr?l? au moins deux
fois par semaine en ce qui concerne la salinit?, le pH, l'ammoniaque, les
nitrites, les nitrates, l'oxyg?ne, les phosphates, le calcium, l'alcalinit?
et les substances organiques en utilisant le mat?riel de contr?le pour aquarium.
La salinit? a ?t? d?termin?e en utilisant un salinom?tre ?lectronique
PinPoint (calibr? ? 53.0 mS utilisant de l'eau de mer IAPSO = IAPSO est
le standard chimique de " l'eau de mer naturelle " utilis? universellement
pour calibrer ses instruments.
La composition exacte se trouve ici: http://www.geochemie.uni-bremen.de/koelling/standards_seawater.html
Le pH a ?t? mesur? avec une sonde ?lectronique PinPoint pH (apr?s 2 points
de calibrage ? 7.0 et 10.0). Tous les autres param?tres de l'eau on ?t?
mesur?s en utilisant des tests standards pour aquarium Salifert en les comparant
avec des standards colorim?triques. Comparaisons de la concentration des
nutriments dans les ?chantillons d'eau de d?but et de fin d?termin?s par
AutoAnalyzer par rapport aux r?sultats obtenus avec les tests Salifert qui
correspondent suffisamment (r2 = 0.75, F = 64.53, P < 0.001) afin
d'utiliser les valeurs des tests pour aquarium comme mesures relatives des
nutriments de l'aquarium durant l'exp?rimentation.
d.) Analyses statistiques
Toutes les analyses statistiques ont ?t? r?alis?es en utilisant une analyse
de variation comme ex?cut? dans JMP in ver. 4.0.2 Academic Version (SAS
Institute Inc.). Nous avons d'abord confirm? la conformit? des hypoth?ses
de normalit? en utilisant le test Shapiro-Wilks et l'homog?n?it? des variations
en utilisant le test Bartletts (a = 0.01) comme ex?cut? dans JMP. Le mod?le
complet ANOVA utilis? comme la pr?sence ou l'absence de pl?num, la taille
moyenne des substrats, la profondeur du lit et les interactions entre eux
comme effets fix?s ; la salinit?, le pH, l'ammoniaque, les nitrites, les
nitrates, l'oxyg?ne, les phosphates, l'alcalinit? et le calcium ont ?t?
mesur?s comme r?actions variables. Des diff?rences significatives parmi
les protocoles pairs (pl?num contre sans pl?num; grains fins contre grossi?rs;
substrat ?pais contre mince) ont ?t? d?termin?es pour chaque r?ponse
variable par des tests comme ex?cut? dans JMP. Les donn?es ont ?t? relev?es
en utilisant PSI Plot ver, 7.01 (Poly Software International, Inc.).
Preuve exp?rimentale
contre preuve anecdotique :
A mon avis, le manque d'exp?rimentations comparatives pour ?valuer les approches
alternatives constitue un d?faut s?rieux dans le hobby aquariophile. Il
existe autant d'approches diff?rentes de maintenance d'un aquarium qu'il
y a d'aquariophiles avec des aquariums r?ussis. Cependant, sans exp?rimentations
contr?l?es et dupliqu?es, nous ne savons finalement rien de plus que quelque
chose EST possible, nous ne savons pas si un bac exactement identique avec
la m?me installation donnerait un r?sultat compl?tement diff?rent ? chaque
fois. C'est pourquoi les chercheurs font l'effort d'inclure leur propres contr?les
et duplications dans leurs exp?rimentations : il nous faut d?terminer si
la variation entre les protocoles install?s de la m?me fa?on sont inf?rieurs
ou sup?rieurs que des protocoles install?s diff?remment. Ceci est particuli?rement
vrai dans le cas d'un syst?me biologique complexe comme un aquarium. Les
?tres humains ont une capacit? remarquable ? se faire des illusions, raison
pour laquelle les chercheurs en m?decine perdent autant de temps en s'inqui?tant
des effets placebo. En fait, chaque rencontre entre un patient conscient et
un docteur peut potentiellement initier un effet placebo (Hr?bjartsson 1996).
Parce qu'il est virtuellement impossible d'obtenir un contr?le fiable (no
placebo) lors des exp?rimentations m?dicales, les effets des m?dicaments
sont toujours test?s par rapport ? l'administration de placebo ? leur place.
M?me sans ingr?dient actif, certaines personnes montrent une am?lioration
dramatique apr?s le traitement avec un m?dicament placebo (e.g., Hr?bjartsson
1996). ?tant donn? que certaines personnes sont capables de se convaincre
elles-m?mes qu'une maladie est gu?rie par des pilules sucr?es, il n'est
pas ?tonnant qu'autant de personnes sont convaincues que certains additifs
ou traitements sont responsables de la prosp?rit? de leur bac.
Avec ces lignes, les aquariophiles du monde entier ont perdu d'innombrables
heures discutant du pour et du contre relatifs des diff?rents conceptions
d'aquariums. Je voudrais soutenir que la passion est bonne pour notre hobby,
mais il nous faut de vraies donn?es pour ?valuer comment les diff?rentes
options remplissent leur r?le avant de pouvoir prendre une d?cision bien
inform?e sur la meilleure mani?re d'installer un aquarium. Il est douteux
d'avoir des donn?es parce que il y a toujours des variations parmi les exp?rimentations
(voir Fig. 2). Un r?sultat donn? est seulement pr?visible si la variation
entre les protocoles est inf?rieure ? la variation d'un protocole au suivant.
Je sais que ceci peut ne pas ?tre sens? mais servons nous d'un exemple simple
pour expliquer son importance. Vous installez un bac avec un filtre cuve et
un bac avec un filtre sous sable et vous trouvez que le bac avec le filtre
cuve a un meilleur aspect. A partir de cette constatation, vous n'installez
plus que des bacs avec des filtres cuves et certains ont un meilleur aspect
que l'original et d'autres m?me moins bien que l'original bas? sur le filtre
sous sable. Si les variations sont nombreuses d'un bac ? un autre ceci peut
constituer un exemple extr?me, mais c'est exactement ce qui arrive dans la
r?alit? et dans nos exp?rimentations.
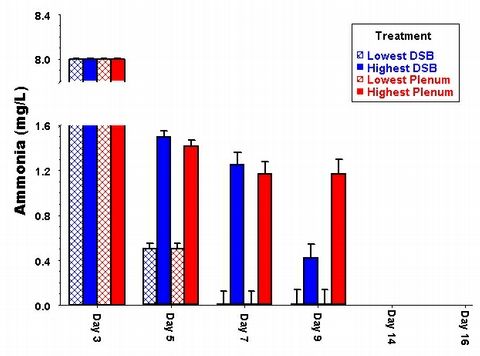
Figure 2: Variation parmi les protocoles au fil du temps dans des bacs d'installation
identique sans animaux dans
les exp?rimentations avec les aquariums de dosage. Notez que le valeurs les
plus basses et les plus ?lev?es pour
chaque protocole diff?re davantage que la valeur moyenne de tous les aquariums
inclus dans ce protocole exp?rimental.
M?me en laboratoire, des aquariums install?s de la m?me fa?on ? partir d'un simple pool bien m?lang? de sable et d'eau de mer ne contenant aucun animal vivant pr?sentent une quantit? impressionnante de variations parmi les essais (Fig. 3). Je suis s?r que vous pouvez imaginer combien de variations diff?rentes il pourrait y a avoir parmi les bacs install?s par diff?rentes personnes en diff?rents endroits et avec des mat?riaux et des animaux diff?rents ! Ce n'est qu'en ayant correctement dupliqu? les exp?rimentations que nous pouvons ?valuer si le protocole lui-m?me donne un r?sultat ou si les diff?rences parmi les bacs sont simplement dus ? la chance al?atoire. Si vous ne pouvez pas r?p?ter les r?sultats que vous essayez de cr?er, alors le r?sultat a manifestement peu ? voir avec le protocole que vous avez exp?riment?. Ceci constitue l'un des probl?mes de l'amateurisme : trop souvent nous prenons l'exemple unique d'un aquarium r?ussi comme ''preuve'' que la conception ou l'additif fonctionne bien. Cependant, le plus souvent lorsqu'en tant qu'aquariophile amateur vous essayer de reproduire le r?sultat spectaculaire d'un aquarium donn?, le r?sultat est quelque peu moins spectaculaire.
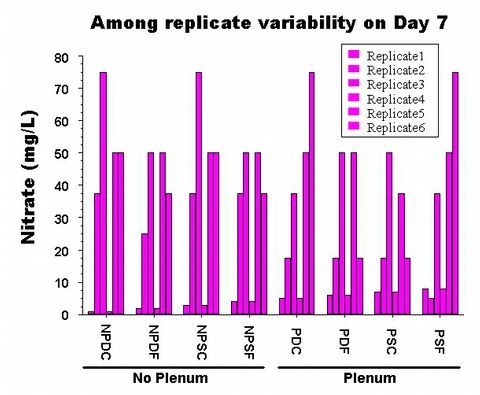
Figure 3: Les valeurs r?elles de 6 aquariums dupliqu?s sept jours apr?s
la p?riode initiale de rodage ?tait termin?e.
Manifestement il y a plus de variation dans les bacs install? de la m?me
mani?re qu'il n'y en a parmi la valeur
moyenne de chaque protocole.
Finalement
la question ? laquelle nous devons r?pondre est si la moyenne de plusieurs
installations dupliqu?es de bacs ou trait?s de la m?me mani?re se portent
tous mieux que la moyenne de plusieurs bacs dupliqu?s sans cet additif ou
install? d'une mani?re diff?rente.
Nos r?sultats exp?rimentaux
:
a.) Exp?rimentation avec les aquariums de dosage
Les s?ries chronologiques des concentrations d'ammoniaque, de nitrites et
de nitrates dans les aquariums ont montr? peu de diff?rences parmi les traitements
(Fig. 4-6). Apr?s le 21 ?me jour, il n'y avait pas de diff?rence notable
entre l'ammoniaque, le nitrites, les nitrates, le pH ou la salinit? mesur?s
pour chaque traitement ? la fin de l'exp?rimentation. Les analyses de variation
n'ont pas r?v?l? de diff?rence notable parmi les concentrations finales
de sel, d'ammoniaque, de nitrites, de nitrates, d'oxyg?ne ou de substances
organiques il n'y avait pas non plus d'interactions importantes parmi les
traitements exp?rimentaux pour chacun de ces param?tres de l'eau. Il y avait
cependant des diff?rences notables parmi les traitements pour chacun des
param?tres suivants : pH, phosphates, alcalinit? et calcium.
A la fin de l'exp?rimentation, le pH ?tait notablement plus ?lev? dans
les aquariums avec un substrat fin (7.98 ? 0.01 SE) que grossier (7.91 ?
0.01 SE) (df = 1, F = 10.31, p <0.01). Les phosphates ont fini de mani?re
nettement plus ?lev?e dans les aquariums avec du substrat grossier (0.32
mg / L ? 0.01 SE) que fin (< 0.01 mg / L ? 0.01 SE) (df = 1, F = 211.37,
p < 0.001). L'alcalinit? ?tait plus ?lev?e dans les bacs avec substrat
fin (2.36 meq / l ? 0.08 SE) que dans les bacs avec du substrat grossier
(1.80 meq / l ? 0.08 SE) (df = 1, F = 23.21, p < 0.001), et dans les bacs
avec pl?num (2.20 meq / L ? 0.08 SE) que sans pl?num (1.99 meq / l ? 0.08
SE) (df = 1, F = 4.86, p < 0.05). Aucune autre source de conditions variables
ou d'interactions n'?taient significatives pour les valeurs finales du pH,
des phosphates ou de l'alcalinit?. Finalement, les quantit?s de calcium
dans les aquariums exp?rimentaux ?taient notablement diff?rentes entre
les ?paisseurs et la taille des grains des substrats et il y avait des interactions
importantes entre la pr?sence d'un pl?num et ? la fois la taille des grains
et l'?paisseur du substrat (Tableau).
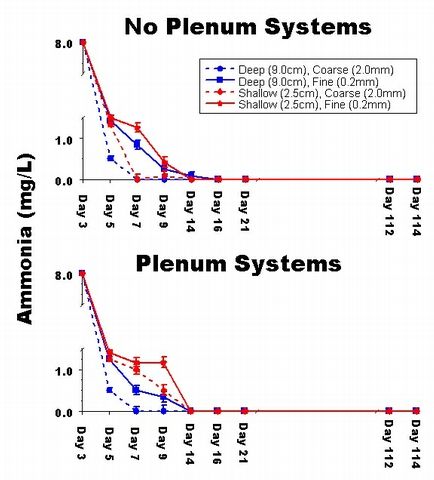
Figure 4: Graphique des s?ries chronologiques de la concentration moyenne
d'ammoniaque (mg/l) dans
les aquariums exp?rimentaux.
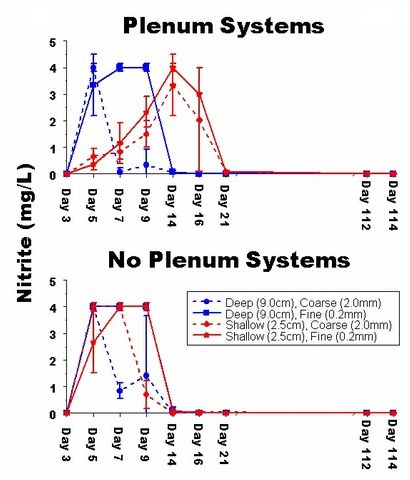
Figure 5: Graphique des s?ries chronologiques de la concentration moyenne
des nitrites (mgl) dans
les aquariums exp?rimentaux.
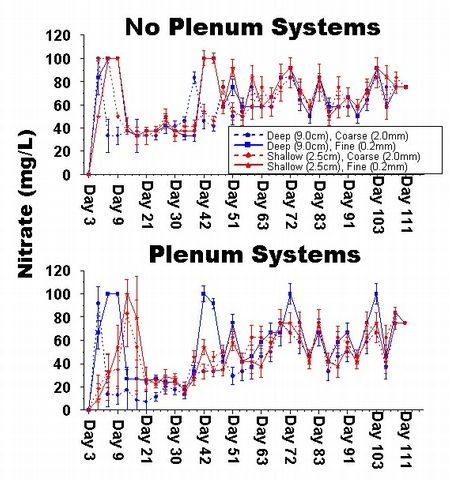
Figure 6: Graphique des s?ries chronologiques des concentrations moyennes
de nitrates (mg/l) dans
les aquariums exp?rimentaux.
|
Source
|
Df
|
MS
|
F
|
P-value
|
|
Pl?num
ou pas
|
1
|
16.67
|
0.02
|
0.88
|
|
Taille
des grains
|
1
|
4816.67
|
6.97
|
0.02
|
|
Épaisseur
du suvstrat
|
1
|
4266.67
|
6.17
|
0.02
|
|
Plénum
x taille grain
|
1
|
4816.67
|
6.97
|
0.02
|
|
Plénum
x épaisseur lit
|
1
|
4816.67
|
6.97
|
0.02
|
|
Taille
grain x épaisseur lit
|
1
|
266.67
|
0.39
|
0.54
|
|
Plénum
x taille grain x épaisseur
|
1
|
1666.67
|
2.41
|
0.14
|
|
Modèle
global
|
7
|
2952.37
|
4.27
|
0.007
|
|
Erreur
|
16
|
691.67
|
Nota
: SE = ?cart type ; Df = degr? de libert? ; F = valeur
du test ANOVA (analyse de variance) ; P = probabilit? d'erreur
Globalement, la pr?sence ou l'absence de pl?num ont constitu? une diff?rence
faible par rapport ? la performance des substrats dans la transformation
des nutriments de l'aquarium. (Fig. 7). Il n'y a pas de diff?rence parmi
les concentrations finales en d?chets azot?s dans les bacs avec ou sans
pl?num. De la m?me fa?on l'?paisseur avait peu d'effet global sur les
valeurs finales des param?tres de l'eau dans chacun des protocoles exp?rimentaux.
(Fig. 8). L'effet le plus important observ? lors de l'exp?rimentation de
dosage a port? sur les param?tres associ?s avec le pouvoir tampon des substrats
lors des essais de grains de taille moyenne plut?t que la capacit? de traitement
des d?chets azot?s (Fig. 9).
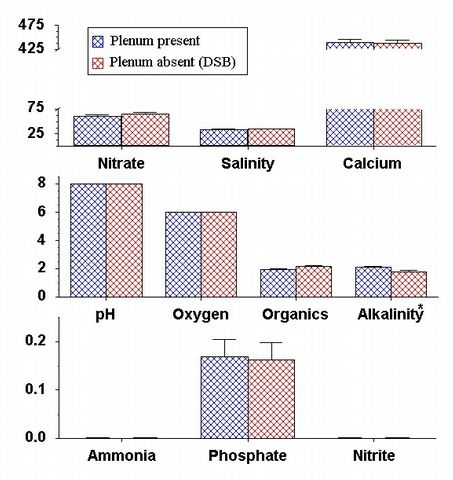
Figure
7: Comparaison des concentrations finales de nutriments dans les aquariums
exp?rimentaux avec et sans
pl?num. R?sultats des protocoles avec les aquariums de dosage (dose) et
ceux avec des animaux vivants (live)
pr?sent? c?te ? c?te ; les protocoles qui sont notablement diff?rents
sont signal?s par une ligne au dessus des
barres. La salinit? est mesur?e en mS, l'alcalinit? en meq et les substances
organiques sont pr?sent?es comme
un rapport de mesure colorim?trique. Les nitrates, le calcium, l'oxyg?ne,
l'ammoniaque, les phosphates et les
nitrites sont tous pr?sent?s en mg / L.
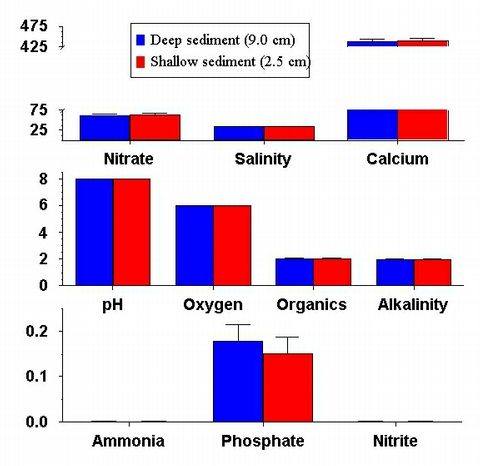
Figure 8: Comparaison des concentrations finales de nutriments dans les aquariums
exp?rimentaux avec substrats
?pais (9.0cm) et minces (2.5cm). R?sultats des protocoles des aquariums
de dosage (dose) et ceux avec animaux
vivants (live) sont pr?sent? c?te ? c?te ; les protocoles qui sont notablement
diff?rents sont signal?s par une ligne
au dessus des barres. Les param?tres de l'eau sont mesur?s comme dans la
figure 7.
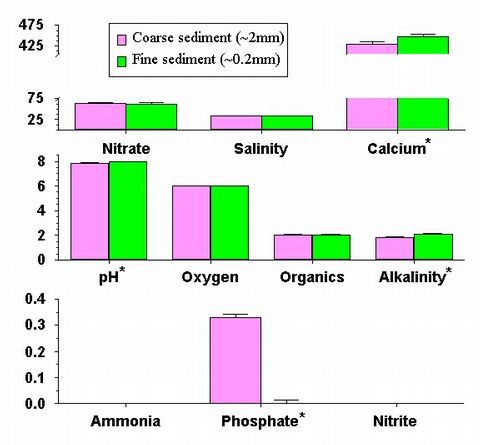
Figure 9: Comparaison des concentrations finales de nutriments dans les aquariums
exp?rimentaux avec grains
grossiers (2.0 mm diam?tre moyen) et fins (0.2 mm diam?tre moyen). R?sultats
des protocoles des aquariums
de dosage (dose) et ceux d'animaux vivants (live) sont pr?sent? c?te ?
c?te ; les protocoles qui sont notablement
diff?rents sont signal?s par une ligne au dessus des barres. Les param?tres
de l'eau sont mesur?s comme dans
la figure 7.
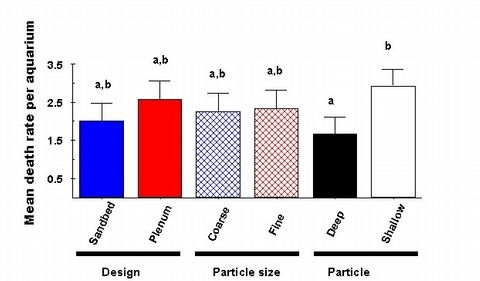
Figure 10: Comparaison du taux de mortalit? moyen des animaux lors de chaque
protocole exp?rimental. Les lettres
au dessus des barres repr?sentent des groupes qui ne diff?rent pas notablement
les uns des autres. Les seules
diff?rences statistiquement notables parmi les protocoles sont que les substrats
minces pr?sentent notablement
plus de d?c?s d'animaux durant le protocole que ce n'est le cas des essais
avec substrat ?pais.
b.) Exp?rimentations avec les aquariums avec animaux vivants
Les trac?s des s?ries chronologiques de la mesure des nutriments lors des
exp?rimentations avec les animaux vivants ont ?t? qualitativement similaires
? ceux des exp?rimentations de dosage et ne sont pas inclus ici pour cette
raison. Comme pour les exp?rimentations de dosage ci dessus, les s?ries
chronologiques des concentrations dans les aquariums de pH, de salinit?,
d'ammoniaque, de nitrites et de nitrates n'ont pas montr? de diff?rences
notables entre les protocoles (donn?es non cit?es). Les analyses de variance
pour chaque param?tre de l'eau n'ont pas r?v?l? de diff?rences importantes
? propos des concentrations finales de salinit?, d'ammoniaque, de nitrites,
d'oxyg?ne ou de substances organiques, il n'y avait pas non plus d'interactions
significatives ? propos des traitements exp?rimentaux pour chacun ces param?tres
de l'eau. (donn?es non cit?es). Il y a des diff?rences importantes parmi
les protocoles pour les param?tres restants de l'eau, toutefois les variations
sont uniform?ment plus importantes parmi les protocoles incluant les animaux
vivants que lors des exp?riences de dosage.
A la fin de l'exp?rimentation, le pH ?tait significativement plus ?lev?
dans les aquariums ? substrat fin (8.22 ? 0.02 SE) que ceux ? substrat
grossier (8.10 ? 0.02 SE) (df = 1, F = 7.68, p = 0.01). Pour les nitrates,
l'analyse globale des variations n'?tait pas importante (df = 7, = 1.25,
p = 0.34). Cependant il y avait un effet d'interaction notable de la taille
des grains en fonction de l'?paisseur (df = 1, F = 6.48, p = 0.02), dans
lequel les substrats ?pis et grossiers (12.08 mg / L ? 6.89 SE) et les fins
peu ?pais (20.42 mg / L ? 6.89 SE) pr?sentaient r?guli?rement la plus
faible concentration finale en nitrates. Les phosphates ?taient au final
bien plus ?lev?s dans les aquariums avec substrats grossiers (0.35 ppm ?
0.02 SE) que fins (0.02 ppm ? 0.02 SE) (df = 1, F = 119.69, p < 0.01). Les
phosphates ?taient aussi bien plus ?lev?s parmi les substrats grossiers
(0.22 mg / L ? 0.02 SE) que parmi les fins (0.15 mg / L ? 0.02 SE) (df =
1, F = 5.70, p = 0.03), bien que cette comparaison ne soit pas importante
apr?s la correction de Bonferroni. (Il s'agit d'une correction pour des test
multiples. Si vous effectuez assez de tests, l'un d'entre eux sera par hasard
significatif, ainsi nous corrigeons nos statistiques en faisant de nombreux
tests. C'est la correction de Bonferroni.) L'alcalinit? ?tait bien plus
?lev?e dans les bacs avec substrat fin (1.97 meq / L ? 0.06 SE) qu'avec
substrat grossier (1.69 meq / L ? 0.06 SE) (df = 1, F = 12.03, p < 0.01).
Finalement, les concentrations de calcium ?taient bien plus ?lev?es dans
les bacs avec substrat fin (340.42 mg / L ? 2.89 SE) que ceux avec substrat
grossier (327.92 mg / L ? 2.89 SE) (df = 1, F = 9.35, p < 0.01).
Aucune autre source de conditions de variations ou d'interactions n'avait
d'importance, toutefois presque toute montrait des tendances similaires aux
exp?rimentations de dosage. Globalement la plupart des comparaisons qui avaient
une importance lors des exp?rimentations de dosage ?taient aussi proches
du significatif (0.1 < p > 0.05) en d?pit de la variabilit? plus importante
lors des essais avec les animaux vivants; ces r?sultats sugg?rent que la
taille augment?e d'un ?chantillon peut montrer des tendances identiques
entre deux exp?rimentations. En fait, le seul param?tre qui a montr? des
r?sultats oppos?s entre les exp?rimentations de dosage et celles avec des
animaux vivants a ?t? l'alcalinit? en pr?sence ou en absence de pl?num
(Fig. 7).
Nous avons aussi suivi la progression des d?c?s d'animaux lors des exp?rimentations
avec les animaux vivants. Chaque animal lors de l'exp?rimentation a ?t?
trait? comme ?quivalent et le nombre total d'individus qui a n?cessit?
le remplacement au long de l'exp?rimentation a ?t? compar? parmi les traitements.
Bien que l'analyse globale des variations n'ait pas ?t? importante (df =
7, F = 0.88, p > 0.5), il y a eu un r?sultat notable de l'?paisseur du substrat
sur le taux de mortalit?. En moyenne 2.91 ? 0.46 des animaux ont du ?tre
remplac?s lors des protocoles avec des substrats peu ?pais, tandis que seulement
1.47 ? 0.46 des animaux ont du ?tre remplac?s lors des essais avec substrat
?pais (df = 1, F = 5.23, p < 0.05). Aucune autre condition de protocole ou
d'interaction n'a affect? de mani?re importante le taux de mortalit? lors
de ces exp?rimentations en aquariums.
Discussions & conclusions
:
Les aquariums publics et les amateurs ont longtemps utilis? des syst?mes
de recirculation bas?s sur certaine forme de filtration sur substrat pour
aider la transformation des d?chets azot?s produits par les habitants du
bac (v?rifi? par Delbeek & Sprung 1994a, 1994b, Carlson 1999, Borneman &
Lowrie 2001, sous presse). La conception de ces unit?s de filtration sur
substrat pour des syst?mes de recirculation afin d'?lever des organismes
coralliens s'est en grande partie orient?e vers quelques types majeurs :
berlinois, syst?mes bas?s sur le lit de sable et celui bas? sur le pl?num.
Toutefois, ces syst?mes peuvent ?tre consid?r?s comme une continuit?
de pratiquement pas de substrat et une confiance compl?te sur les pierres
vivantes dans le syst?me berlinois ? des quantit?s extr?mes de substrat
dans certains syst?mes de lit de sable ?pais. Malgr? la diversit? des
opinions concernant la valeur de ces conceptions, l'utilit? relative de chacun
de ces types et la mani?re la plus efficace de les concevoir font toujours
l'objet de controverses consid?rables (v?rifi? par Toonen 2000a, b). Il
existe quelques ?tudes de comparaison des performances relatives d'une conception
donn?e (e.g., Auger 1999, Hovanec 2003), cependant ces ?tudes n'ont pas
?t? dupliqu?es et montrent les r?sultats de comparaisons d'un seul aquarium
pour chaque conception. Comme d?montr? m?me les exp?rimentations de dosage
en aquarium sans aucun animal vivant pr?sentent trop de variations parmi
des installations identiques pour tirer toute conclusion bas?e sur un seul
bac.
Les diff?rentes opinions et les d?bats permanents nous ont conduit ? d?marrer
cette exp?rimentation et ici nous pr?sentons les premi?res donn?es exp?rimentales
dupliqu?es en comparant directement une diversit? de conceptions d'aquariums
? recirculation. Nous avons cr?? une conception exp?rimentale contr?l?e
et dupliqu?e afin de d?terminer les effets relatifs de la pr?sence ou de
l'absence d'un pl?num, de l'?paisseur du substrat et de la taille des grains
dans le lit de sable sur la concentration des nutriments dans l'aquarium.
En mettant de c?t? toutes les rh?toriques et les opinions, nos exp?rimentations
ont montr? que les bacs avec et sans pl?num ont une efficacit? ?gale (au
moins durant les premiers mois du test) en maintenant des param?tres convenables
de l'eau pour un syst?me d'aquarium ? recirculation.
En terme de transformation des d?chets azot?s provenant des habitants de
l'aquarium (sp?cifiquement l'ammoniaque, les nitrites et les nitrates) aucun
des traitements exp?rimentaux (pl?num contre lit de sable, ?pais contre
mince ; grossier contre fin) n'ont paru d?velopper un avantage important
(Fig. 7 - 9). Apr?s une p?riode de stabilisation initiale, tous les traitements
exp?rimentaux ont r?pondu de la m?me mani?re ? l'apport continu d'ammoniaque
jusqu'? 0.5mg NH4+ / l / jour. Comme mentionn? plus haut, cet
apport est ? peu pr?s ?quivalent ? celui d'aquariums r?cifaux lourdement
charg?s. Les diff?rences importantes parmi les protocoles lors cette exp?rimentation
n'ont pas impliqu? les d?chets azot?s et ont ?t? d'abord apparent?s
? la capacit? tampon du substrat sur l'eau du bac ? recirculation (Fig.
7 - 9). L'interaction de l'?paisseur et la taille des grains du lit de substrat
ont ?t? ? l'origine de la plus grande diff?rence pour la performance globale
du syst?me ? travers ces exp?rimentations et la pr?sence ou l'absence
de pl?num sous ces substrats n'a pas montr? d'effet important sur chaque
param?tre exp?rimental mesur? (Fig. 7). Aucun des syst?mes n'a paru atteindre
la capacit? maximale de transformation des d?chets azot?s, parce qu'en
l'espace de deux semaines ? partir du d?marrage de chaque exp?rimentation,
ni ammoniaque ni nitrite n'ont ?t? d?tectables dans l'eau de l'aquarium
jusqu'? la fin de l'exp?rimentation (Fig. 4-5). De la m?me fa?on, le taux
d'augmentation des nitrates dans les bacs exp?rimentaux ?tait de loin inf?rieur
au taux de l'apport d'azote ? l'aquarium (Fig. 6). Ainsi, chaque syst?me
de filtration sur substrat test? ici est paru capable de traiter la charge
biologique de test et il ne semble pas y avoir eu de b?n?fice important
pour la transformation des d?chets azot?s d?riv?s de chacune de ces diverses
conceptions exp?rimentales.
La d?nitrification a d? se produire dans tous les protocoles exp?rimentaux,
parce que les concentrations de nitrates n'ont pas continu? ? grimper, pas
plus dans les exp?rimentations de dosage (Fig. 6) que celles avec les animaux
vivants (donn?es non cit?es). En d?pit de l'addition de NH4+
? un taux de 0.5mg / l / jour lors de l'exp?rimentation de dosage qui a
?t? assez rapidement m?tabolis? pour garder l'ammoniaque et les nitrites
? une quantit? ind?tectable (Fig. 4-5), la concentration de nitrates dans
chaque bac s'est maintenue ? un niveau passablement constant durant les 60
jours ult?rieurs de l'exp?rimentation (Fig. 6). Cependant, semblable aux
r?sultats vus durant la transformation de l'ammoniaque et des nitrites, il
n'y avait pas de diff?rences importantes dans la capacit? de chaque conception
exp?rimentale ? r?duire les nitrates dans ces syst?mes clos.
Avec une seule exception, les r?sultats des exp?rimentations avec les animaux
vivants n'?taient pas qualitativement diff?rents de ceux des exp?rimentations
de dosage sans animaux (Fig. 7 - 9). Seulement l'alcalinit? montrait un exemple
diff?rent de signification lors de la pr?sence ou de l'absence de pl?num
parmi les exp?rimentations de dosage et celles avec animaux vivants. (Fig.
7). Bien que les concentrations finales des nitrates et du calcium ne changeaient
pas parmi les protocoles avec pl?num, ?paisseur de s?diments ou taille
des grains que ce soit lors des exp?rimentations de dosage ou celles avec
des animaux vivants, les deux diff?raient de fa?on importante entre les
deux exp?rimentations. Les concentrations de nitrates des aquariums exp?rimentaux
avec animaux vivants ?taient significativement inf?rieures (15.15 ? 17.51)
que celles des exp?rimentations de dosage (62.76 ? 14.47) (df = 1, F = 150.33,
p < 0.01). De la m?me mani?re les concentrations finales de calcium des
aquariums exp?rimentaux avec animaux vivants (334.17 ? 11.81) ?taient significativement
plus basses que celles des aquariums d'exp?rimentation de dosage (446.67
? 37.15) (df = 1, F = 199.95, p < 0.01).
Nous ne pouvons pas exclure la possibilit? selon laquelle la pr?sence d'animaux
vivants dans l'aquarium peut modifier la capacit? tampon ou le taux de d?nitrification.
Cependant l'explication la plus probable pour les concentrations finales diminu?es
de calcium est constitu?e par la consommation par les organismes dans les
aquariums d'essai. Il est possible d'affirmer la m?me chose pour la concentration
de nitrates, mais il existe au moins trois explications potentielles suppl?mentaires
pour les diff?rences dans la concentration finale des nitrates entre les
essais avec les animaux vivants et ceux de dosage.
En premier lieu, la pr?sence de d?bris de coraux (pierres vivantes) lors
des essais avec animaux vivants pourraient bien avoir augment? la capacit?
de filtration biologique et pourrait expliquer les concentrations finales
r?duites de nitrates. En second lieu, les d?chets introduits dans l'aquarium
par les animaux vivants ont pu ?tre plus faibles que 0.5mg NH4+
/ l / jour Bas? sur un calcul approximatif de production de d?chets azot?s
de taille sp?cifique par Quian et ses coll?gues (2001) nous estimons que
le taux de production d'ammonium lors des essais avec animaux vivants sont
plus proches de 0.08 NH4+
/ l / jour. Finalement, les essais avec animaux vivants ont ?t? men?s ?
l'ext?rieur sous le voile d'ombrage et la pr?sence des algues lors de ces
protocoles pourrait expliquer la mont?e significative des nitrates par rapport
aux aquariums de dosage. D'autres exp?rimentations seraient n?cessaires
pour aborder la cause sp?cifique des concentrations r?duites de nitrates
lors des essais avec des animaux vivants, mais finalement la majorit? des
capacit?s de transformation des nutriments s'explique par les processus microbiens
et la pr?sence d'animaux vivants n'a qu'un faible effet global sur les sch?mas
observ?s (Fig. 7 - 9).
Sans ce soucier de la cause finale des diff?rences que nous avons observ?es,
ces exp?rimentations sugg?rent encore que la pr?sence ou l'absence d'animaux
vivants et d'endofaune du substrat ont peu de rapport avec la capacit? de
transformation des nutriments du substrat (du moins ? l'?chelle de temps
couverte par cette exp?rimentation). Toutefois la question de savoir comment
extrapoler ces r?sultats ? des aquariums plus grands et le r?le de l'endofaune
du substrat dans la stabilit? ? long terme des syst?mes reste certainement
un sujet d'?tudes futures.
Peut-?tre les r?sultats les plus troublants r?sultant de cette exp?rimentation
sont constitu?s par l'interaction importante de la taille des grains du substrat
et l'?paisseur dans les aquariums. La simple pr?diction bas?e sur l'?paisseur
du lit de sable voudrait que les substrats plus ?pais et plus fins ont toujours
diminu? la p?n?tration de l'oxyg?ne et ainsi augment? la capacit? de
transformation des nitrates (Toonen 2000a, b, Shimek 2001, Delbeek & Sprung
sous presse). Ainsi, il est difficile d'expliquer pourquoi des substrats ?pais,
grossiers (27.41 mg / l ? 6.89 SE) et des minces, fins (20.42 mg / l ? 6.89
SE) ont la concentration finale moyenne la plus ?lev?e en nitrates tandis
que les substrats minces, grossiers (12.08 mg / l ? 6.89 SE) et les ?pais,
fins (0.67 mg / l ? 6.89 SE) ont r?guli?rement les concentrations finales
en nitrates les plus basses. La r?duction des nitrates dans des substrats
?pais s'explique facilement par la p?n?tration r?duite de l'oxyg?ne dans
les substrats. Cependant les concentrations finales augment?es de nitrates
dans les aquariums avec des substrats ?pais, grossiers et minces, fins par
rapport au protocole mince, grossier sont plus difficiles ? comprendre. Des
recherches compl?mentaires seront n?cessaires pour expliquer la source de
d?nitrification dans les substrats minces, grossiers et rendre comte de ce
r?sultat inattendu. Au cours de sa pr?sentation lors de MACNA XVI, Julian
Sprung a pr?sent? ses recherches sur les effets physiques du mouvement de
l'eau sur la capacit? de filtration biologique des lits de substrats dans
les aquariums. La conclusion de base de ce travail repris avec plus de d?tails
dans Delbeek & Sprung sous presse) est que la situation et le volume de la
pierre aussi bien que la forme de la surface du sable ou du gravier (par exemple
monticules, en pente ou plat) peuvent dramatiquement influencer l'efficacit?
du courant d'eau, la diffusion de l'oxyg?ne et le d?bit des nutriments dans
le lit de sable. Les r?sultats pr?sent?s ici soutiennent qu'il y a des
interactions complexes entre l'?paisseur du lit de sable, la taille des grains
et le courant. Manifestement des recherches compl?mentaires au cours de cet
article semblent prouver de mani?re tr?s fructueuse notre compr?hension
finale de la filtration biologique dans les aquariums ? recirculation.
Globalement ces r?sultats sugg?rent qu'il n'y a pas de diff?rence mesurable
entre la plupart de ces concepts courants de filtration sur substrat pour
la maintenance de param?tres convenables de l'eau. Il n'y a pas de diff?rences
importantes concernant l'?paisseur, la taille des grains ou le pl?num pour
le traitement de l'ammoniaque ou des nitrites dans les aquariums ? recirculation.
Les substrats ?pais, fins pr?sentaient la concentration finale en nitrates
la plus faible lors de ces essais, mais ces valeurs ne sont pas moins importantes
que la concentration finale moyenne en nitrates des protocoles ? substrats
minces, grossiers. Donc contrairement ? nos espoirs, la pr?sence ou l'absence
d'animaux vivants et d'endofaune du lit de sable n'ont pas cr?? de diff?rence
significative pour les concentrations de nutriments durant la p?riode de
test.
Les diff?rences significatives parmi les protocoles exp?rimentaux ont d'abord
?t? dans la capacit? tampon des substrats plut?t que dans la d?composition
biologique des produits des d?chets azot?s. Les diff?rences les plus importantes
ont ?t? not?es dans la concentration finale des phosphates : les protocoles
avec substrat grossier ont approximativement une concentration finale 17 fois
plus importante que celle des aquarium au protocole avec grains fins. Parce
que nous n'avons pas tamis? les diff?rentes tailles des grains provenant
d'une seule source nous ne pouvons pas dire que les diff?rences de pouvoir
tampon constituent uniquement le r?sultat de la taille des grains. La capacit?
tampon pourrait facilement ?tre l'effet des sources particuli?res de sables
utilis?s et nous recommandons aux amateurs de tester la solubilit? du sable
choisi avant d'en ajouter un volume important ? leur aquarium.
Par contraste, il n'y avait pas de diff?rence notable parmi les protocoles
concernant la capacit? des aquariums exp?rimentaux pour transformer les
d?chets azot?s (ammonique, nitrites et nitrates). Il n'y avait pas de diff?rence
notable dans chaque param?tre de l'eau mesur? entre les bacs qui contenaient
un pl?num et ceux qui n'en avaient pas (Fig. 7). De la m?me fa?on, l'?paisseur
des substrats n'avait pas d'effet mesurable sur la concentration finale des
nutriments dans chacun des aquariums exp?rimentaux (Fig. 8). Les seules diff?rences
importantes parmi les aquariums exp?rimentaux ont ?t? not?es au sujet
de la capacit? tampon des lits de substrats grossiers et fins Fig. 9). Cependant
comme mentionn? pr?c?demment, les diff?rences vues dans la fig. 9 peuvent
compl?tement d?river des diff?rences dans la constitution des substrats
choisis pour l'exp?rimentation plut?t que de la cons?quence directe de
la taille des grains.
Finalement, j'imagine que la plupart des aquariophiles sont moins concern?
par les concentrations exactes de chacun des param?tres de l'eau et sont
en premier lieu concern?s par la survie ou pas des animaux dans leurs aquariums.
Notre exp?rimentation a montr? que les lits de sable ont des taux de mortalit?
inf?rieurs que les syst?mes bas?s sur le pl?num et la mortalit? dans
les bacs avec substrat grossier ?tait l?g?rement plus faible que dans ceux
bas?s sur le substrat fin, mais aucun r?sultat n'?tait significatif (Fig.
10). Le seul r?sultat notable ?tait le taux de mortalit? avec le substrat
mince qui ?tait plus ?lev? que celui des bacs avec des substrats ?pais
et le taux de mortalit? le plus ?lev? de tous ?tait avec les substrats
minces, grossiers ce qui ressemble le plus au syst?me berlinois utilisant
uniquement des pierres vivantes et un lit de sable tr?s mince. Ainsi, notre
exp?rimentation ne montre pas d'?vidence pour tous b?n?fices d'un pl?num
et sugg?re que tous b?n?fices not?s sont la cons?quence directe des substrats
eux-m?mes plut?t que de l'espace vide situ? en dessous. Nous ne pouvons
aborder les r?sultats ? long terme de cette exp?rimentation et nous esp?rons
que d'autres vont relancer ce travail pour aborder ce probl?me. Cependant,
au moins durant la p?riode o? nous avons men? les tests nos r?sultats
n'ont pas montr? d'avantages mesurables pour l'inclusion d'un espace vide
sous le lit de sable d'un aquarium con?u d'apr?s la recirculation.
Conclusion :
1. Chaque aquarium bas? sur le substrat a paru ?tre capable de traiter les
apports de nutriments jusqu'? 0.5 mg / l / jour de NH4+.
Avec ce taux d'apport les concentrations finales d'ammoniaque, de nitrites
et de nitrates ne diff?rent pas de mani?re significative parmi les aquariums
1) avec ou sans pl?num,
2) contenant des substrats ?pais (9.0 cm) ou minces (2.5cm) ou 3) contenant
des grains de taille moyenne grossi?re (2.0mm) ou fine (0.2mm).
2. Les plus grandes diff?rences parmi les protocoles exp?rimentaux ont ?t?
observ?s sous forme de diminution du pouvoir tampon et une concentration
finale en phosphates plus ?lev?e des aquariums avec substrat ?pais par
rapport ? ceux avec des substrats fins. Cependant la composition chimique
du sable peut ?tre responsable de ce r?sultat et nous n'avons pas test?
d'autres sortes de sable de taille similaire.
3. Globalement les taux de mortalit? sont approximativement le double dans
les aquariums avec substrat mince que dans ceux avec s?diments ?pais. Les
taux de mortalit? de nos aquariums exp?rimentaux ne sont pas notablement
diff?rents au cours de n'importe quel autre protocole.
4. Les r?sultats exp?rimentaux sont qualitativement semblables aussi bien
parmi les aquariums de dosage que ceux avec des animaux vivants. La pr?sence
des animaux vivants et l'endofaune du substrat n'ont pas de r?sultat mesurable
sur les concentrations finales des nutriments de nos aquariums exp?rimentaux.
5. Il n'y a pas d'avantage d?tectable dans l'inclusion d'un pl?num sous
le substrat dans un aquarium avec recirculation.
Remerciements
Cette recherche a en partie ?t? financ?e par le " Program Development Award
to RJT from Hawaii Sea Grant ". Des finances compl?mentaires sont parvenues
par dons de Reed Mariculture, Catalina Aquarium et ma tr?s compr?hensive
?pouse, Carol Fong. Les contr?les de l'eau ont ?t? effectu?s par Saipologa
Toala et Houston Lomae en tant que partie de Pacific Islander Undergraduate
Nous appr?cions ?norm?ment leur assiduit? et leur dur travail en pr?tant
leur concours ? ce projet.
Ce manuscrit a ?t? amend? par des discussions et des commentaires de Charles
Delbeek, Julian Sprung, Richard Harker, Eric Borneman, Tom Frakes, Tim Hovanec
et de nombreux autres excellents aquariophiles lors de " XVI Marine Aquarium
Conference of North America ".
R?f?rences
1. Adey WH, Loveland K (1991) Dynamic Aquaria: Building Living Ecosystems,
Academic Press, San Diego, CA
2. Auger P (1999) The quantitative comparison of two nutrient removal systems.
St. Mary's College, St. Mary's City, MD
3. Borneman EH, Lowrie J (2001) Advances in captive husbandry and propagation:
An easily utilized reef replenishment means from the private sector? Bulletin
of Marine Science 69:897-913
4. Carlson BA (1999) Organism responses to rapid change: What aquaria tell
us about nature. American Zoologist 39:44-55
5. Delbeek JC, Sprung J (1994a) The Reef Aquarium, Vol. 1, Ricordea Publishing,
Coconut Grove, FL
6. Delbeek JC, Sprung J (1994b) The Reef Aquarium, Vol. 2, Ricordea Publishing,
Coconut Grove, FL
7. Delbeek JC, Sprung J (In press) The Reef Aquarium, Vol. 3, Ricordea Publishing,
Coconut Grove, FL
8. Goemans B (1999) Live Sand Secrets - A Dialog on Living Sand Filtration,
Marc Weiss Companies, Inc.
9. Hovanec TA (2003) A comparison of coral reef filtration systems: preliminary
results. SeaScope 20:1-3
10. Hr?bjartsson A (1996) The uncontrollable placebo effect. European Journal
of Clinical Pharmacology 50:345-348
11. Laws EA, Ziemannb D, Schulman D (1999) Coastal water quality in Hawaii:
the importance of buffer zones and dilution. Marine Environmental Research
48:1-21
12. Qian P-Y, Wu MCS, Ni IH (2001) Comparison of nutrients release among some
maricultured animals. Aquaculture 200:305-316
13. Shimek R (2001) Sand Bed Secrets: The common-sense way to biological filtration,
Marc Weiss Companies, Inc.
14. Toonen R (2000a) Are Plenums Obsolete? Another viewpoint, Part 1. Freshwater
and Marine Aquarium (FAMA) 23:44-66
15. Toonen R (2000b) Are Plenums Obsolete? Another viewpoint, Part 2. Freshwater
and Marine Aquarium (FAMA) 23:44-70
16. Tseng K-F, Wu K-L (2004) The ammonia removal cycle for a submerged biofilter
used in a recirculating eel culture system. Aquacultural Engineering 31:17-30
17. Tullock JH (1997) Natural Reef Aquariums, Vol. Microcosm Ltd., Shelburne,
Vermont
