





Carapaces
avec six pattes
Texte et
photos : © Joachim Frische

(Photos : Beate Kostyrka)
Le
r?cif corallien est r?put? pour sa diversit? en organismes. A premi?re
vue il s'agit surtout de poissons et de coraux, qui avec des couleurs enj?leuses
et des formes bizarres attirent l'?il et repoussent ? l'arri?re plan les
autres animaux. Nous, aquariophiles d'eau de mer, avons toutefois appris,
que cela vaut la peine de prendre en consid?ration les organismes qui se
trouvent dans l'ombre. Certes ils n'attirent pas obligatoirement par l'?clat
de leurs couleurs mais peuvent ?veiller notre int?r?t par leur mode de
vie caract?ristique, en partie cach?, ou par des comportements particuliers.
Le but de cet article est d'attirer votre attention sur quelques uns de ces
organismes. Ce sont les insectes des mers - les crustac?s.
En ce qui concerne l'histoire du Phylum (Debelius, 2000) les ?crevisses et
les crevettes font partie du Subphyla Crustacea de la classe des Malacostraca.
Cinq ordres font partie de cette classe :
• Ordre: Decapoda (D?capodes): environ. 40 familles
• Ordre : Euphausiacea (Krill): 1 famille
• Ordre : Stomatopoda (Squilles): 9 familles
• Ordre: Amphipoda (Puces d'eau): 6 familles
• Ordre: Isopoda (Aselles): 7 familles
• Ordre: Mysidacea (Mysis): 1 famille
 |
| Neopetrolistes ohshimai |
La
plupart des esp?ces convenant pour l'aquariophilie d'eau de mer proviennent
de l'ordre Decapoda. M?me si l'ensemble des ordres list?s n'est pas maintenu
en aquarium r?cifal, l'aquariophile marin a pourtant d?j? fait connaissance
avec l'un ou l'autre, ou le conna?t et appr?cie sa valeur en tant que nourriture.
Le krill et le mysis contribuent ? la sati?t? de nos poissons et leur fournissent
les vitamines. Le mysis n'est pas seulement connu comme nourriture. A de nombreuses
reprises, il arrive que l'aquariophile introduise ? son insu du mysis tropical
avec les pierres vivantes. Ce n'est le plus souvent qu'? la lumi?re bleue
lors du cr?puscule qu'il l'aper?oit, lorsque deux petits points iris?s
attirent l'attention. Le petit mysis se presse ? l'abri d'une grotte et fait
croire ? l'aquariophile au succ?s d'une reproduction qui s'est produite
spontan?ment. Ainsi certains reconnaissent dans ces petits compagnons vifs
des larves de poissons, d'autres voient en ce petit mysis l'ach?vement de
la reproduction r?ussie de leurs crevettes.
H?las la vie de ces porteurs de carapace dure peu dans l'aquarium. Rapidement
ils deviennent la proie de pr?dateurs consommant des ?crevisses ou ces petites
crevettes semblent mourir de faim par manque de nourriture planctonique.
L'autre source de nourriture congel?e de nos poissons - le krill - permet
dans son environnement naturel, que surtout les baleines puissent se rassasier
et atteindre des tailles impressionnantes. La raison est constitu?e par la
quantit? importante de prot?ines de ces porteurs de carapaces. H?las cette
teneur en prot?ines devient ensuite pr?judiciable, lorsqu'il s'agit de d?congeler
du krill. Cette nourriture s'alt?re rapidement, ce qui m?ne ? une r?duction
drastique de la quantit? de vitamines.
 |
| Periclimenes brevicarpalis (Photo Aurélien Sapolin) |
Mais
l'int?r?t du krill ne r?side pas uniquement en tant que nourriture. Certainement
que ce crustac? pourrait constituer un pensionnaire int?ressant pour l'aquarium,
s'il n'y avait le probl?me de son alimentation. Une caract?ristique du krill
est repr?sent?e par des organes lumineux g?min?s. La signification de
ces organes lumineux n'est pas encore connue ? ce jour (Debelius, 2000).
Comme je ne m'int?resse dans cet article qu'aux ?crevisses et aux crevettes,
les autres apparent?s tels les crabes restent ignor?s. La plupart d'entre
eux font de toute fa?on partie des repr?sentants que les aquariophiles consid?rent
comme des parasites. Cependant nombre d'entre eux ne sont pas seulement tr?s
attirants par leurs couleurs. Justement les crabes des coraux font sensation
dans le domaine des soins apport?s aux scl?ractiniaires. Tandis que beaucoup
d'auteurs (Foss? & Nilsen, 1998) consid?rent le crabes des coraux comme
commensal - l'utilit? de la communaut? de vie scl?ractiniaire/crabe ne
sert d'avantage qu'au crabe - (Foss? & Nilsen, 1998), d'autres auteurs consid?rent
cette communaut? comme symbiose (Eibert 1999, Frische 1999, Gro?kopf 2002),
?tant donn? que les scl?ractinaires tirent aussi des avantages de la pr?sence
des crabes comme par exemple la protection contre les pr?dateurs, l'?limination
de s?diments et de tissus n?cros?s, l'?limination d'algues. La plupart
des crabes de coraux proviennent de la Famille des Trapeziidae. Les crabes
se diff?rencient par la transformation de la cinqui?me paire de pattes de
la zone branchiale en organe de nettoyage. Outre cela les crevettes et les
?crevisses portent de longues antennes.
Morphologie
et anatomie des crevettes
Morphologie
Les d?capodes se caract?risent par cinq paires de pattes locomotrices, bien
que dans certains groupes des r?gressions ont conduit ? ce que certaines
paires de pattes (le plus souvent celles arri?res) sont totalement absentes.
Les 30 familles des crevettes vraies sont plac?es dans l'infraordre des Caridea.
Le deuxi?me segment abdominal constitue une caract?ristique importante.
Celui-ci recouvre le premier segment (avant) et le troisi?me segment (arri?re).
Le corps des crevettes est fondamentalement allong? et mince, bien qu'il
y ait de nombreuses exceptions. La plupart des crevettes poss?dent des pinces
plus ou moins d?velopp?es sur les premi?res et deuxi?mes paires de pattes
locomotrices, plus rarement sur les autres.
Le corps des crevettes se divise en deux r?gions : la zone t?te-thorax ou
c?phalothorax et la zone arri?re segment?e ou abdomen. Au bout de l'abdomen
se trouve l'?ventail caudal ou telson. Le c?phalothorax est recouvert dorsolat?ralement
par une carapace. La plupart des crevettes poss?dent ?galement une avanc?e
frontale ou rostre ; celui-ci est le plus souvent dent? ou recouvert d'?pines.
A l'exception de certaines formes cavernicoles toutes les crevettes poss?dent
des yeux compos?s pigment?s. Le c?phalothorax porte une rang?e d'une paire
de pattes segment?es : la premi?re et la deuxi?me antenne, la pi?ce buccale,
y compris les maxillip?des et les pattes locomotrices ou p?r?opodes. L'abdomen
porte les pattes de la nage ou pl?opodes.
Anatomie
Syst?me nerveux
D'apr?s Remane et al. (1981) le cerveau se compose d'un ganglion de la gorge
sup?rieure (cerveau ; ganglion c?r?bral) et de deux cordons nerveux ventraux,
dans le trac? desquels se pr?sente un syst?me nerveux conducteur. Le ganglion
de la gorge sup?rieure se compose du protocerebron (responsable du centre
de la vision) et du deuto- et tricerebron (responsables des antennes). Il
s'y d?veloppe des hormones qui sont c?d?es au corps. Le ganglion de la
gorge inf?rieure est responsable de la pi?ce buccale. L'ensemble du syst?me
nerveux est en position ventrale.
 |
| Hymenocera elegans |
Syst?me
des vaisseaux sanguins
Les d?capodes poss?dent un syst?me circulatoire sanguin ouvert, c'est ?
dire qu'entre les art?res et les veines manquent les vaisseaux capillaires
de liaison. Le sang quitte les art?res et p?n?tre dans la cavit? corporelle
ou dans de larges espaces entre les organes, si bien que les tissus baignent
dans le sang. Le sang retrouve le chemin de retour ? partir de ces espaces
vers les veines ouvertes, qui le ram?ne vers le c?ur. Dans les branchies
des r?seaux de tr?s fines veines ressemblant ? des capillaires peuvent
se d?velopper. Le sang p?n?tre lat?ralement par des ouvertures dans le
c?ur ou (plus rarement) par des veine situ?es ? l'arri?re. La sortie du
sang s'effectue par une art?re pourvue de valves. Le c?ur lui-m?me est
?tabli dans un espace rempli de liquide, le sinus p?ricardial. Le c?ur
est fix? ? la paroi corporelle par des bandes ?lastiques ou fibres musculaires.
Le sang est de couleur bleu?tre. Cette couleur r?sulte de l'h?mocyanine,
pigment respiratoire contenant du cuivre. En ce qui concerne l'h?mocyanine,
substance colorante du sang, il s'agit - comme dans le cas de l'h?moglobine,
colorant sanguin rouge - de substances colorantes de la respiration, qui sont
capables de fixer l'oxyg?ne de fa?on r?versible. Un syst?me circulatoire
sanguin ouvert est toutefois dangereux. Deux grosses art?res approvisionnent
la t?te et la queue. Si les crustac?s sont bless?s en ces endroits, elles
se vident ? coup s?r de leur sang.
Syst?me d'excr?tion
Des vaisseaux sp?cifiques font partie des organes d'excr?tion. Il s'agit
d'innombrables tubes fins, qui finissent ? la base de la deuxi?me antenne
ou deuxi?me maxille. Le contenu de ces vaisseaux est dirig? vers le rectum
et quitte le corps par cette voie. Les cellules de stockage constituent une
particularit?, lesquelles circulent comme athrocytes ? travers le corps
chez les crustac?s sup?rieurs. Dans ces cellules sont concentr?s et stock?s
des excr?ments difficilement solubles. Les d?p?ts d'excr?ments dans les
cellules peuvent ?tre pour le corps des concr?ments ou des pigments donnant
de la couleur. L'excr?tion chez les d?capodes est ?troitement li?e ?
la r?gulation ionique et osmotique. La corr?lation se situe dans la diff?rence
osmotique entre les fluides intracellulaires et la concentration ionique entourant
le corps. La composition des fluides corporels propres pr?sente toujours
de nettes diff?rences par rapport aux liquides environnants (r?gulation
des ions). Ainsi la quantit? de potassium est elle augment?e ; les substances
organiques comme les acides amin?s contribuent au maintien de la pression
osmotique. Si une diff?rence de concentration est maintenue entre le liquide
corporel et le liquide ext?rieur, on parle d'osmor?gulation. Les modifications
de la valeur osmotique du milieu ext?rieur sont trait?es de telle mani?re
? ce que par modification de la teneur en eau un transport actif d'ion se
met en route. En outre le corps r?agit par une cr?ation et une d?composition
des acides amin?s dans le corps. La plupart des invert?br?s marins poss?dent
un fluide corporel isoosmotique par rapport au milieu ext?rieur, dont la
valeur osmotique se modifie avec le milieu ext?rieur (animaux poikilosmotique).
De telles formes vivantes incapables d'osmor?gulation ne sont en grande partie
pas capables de vivre dans d'autres milieux ext?rieurs (eau douce ou saum?tre).
Elles d?pendent largement d'une concentration ionique invariable du milieu
ext?rieur (animaux st?nohalins)
Syst?me de digestion
L'appareil digestif commence avec les pi?ces buccales, se poursuit par les
glandes digestives, par l'estomac (g?sier) et termine dans l'intestin, d?sign?
comme rectum fonctionnel. L? se produit la d?shydratation. L'anus forme
la sortie vers l'ext?rieur.
Branchies
Les branchies sont constitu?es par des protub?rances ? la peau mince de
la surface corporelle, dans lesquelles se d?roule en priorit? l'?change
gazeux. Leur tendre structure les rend tr?s vuln?rables et ainsi des protections
se sont form?es sur les branchies, qui justifient la notion d'opercule ou
de couvercle branchial. Chez les esp?ces de crustac?s sup?rieurs nous trouvons
une cavit? respiratoire, qui est constitu?e par les parties lat?rales de
la carapace. Par le transfert de la respiration vers la cavit? respiratoire
il est indispensable d'apporter en permanence de l'eau neuve aux branchies.
Ceci est r?alis? par des parties des extr?mit?s. Le courant d'eau dans
la cavit? respiratoire s'effectue en principe dans un seul sens. C'est pourquoi
nous trouvons une ouverture d'entr?e et une de sortie. Etant donn? que l'eau
environnante n'est pas toujours compl?tement propre, de minuscules particules
sont in?vitablement aspir?es, lesquelles peuvent salir la cavit? respiratoire.
Un tel encrassement est ?vit? de deux mani?res. Soit un filtre ? base
de s?cr?tions glandulaires ou de longs poils sont int?gr?s ? l'entr?e
du courant respiratoire des branchies, ou les particules sont fix?es sur
les branchies par une s?cr?tion glandulaire et d?riv?es par un courant
de mucus.
Syst?me sexuel
Dans le plus simple des cas chez les crustac?s ? sexes s?par?s les organes
sexuels sont form?s par des tubes ou des poches paires. La reproduction elle-m?me
est trait?e dans la famille des Hyppolytid?s.
Organes sensoriels
La reconnaissance de l'environnement s'effectue par les yeux, les antennes
et les extr?mit?s.
 |
| Panulirus versicolor |
*
La vue
Les yeux bien d?velopp?s donnent aux crustac?s une tr?s bonne capacit?
visuelle. Les yeux existent sous deux formes. Les yeux compos?s et l'oeil
nauplien. L'?il nauplien est segment? en trois parties et se trouve sur
la ligne centrale de la t?te. L'oeil compos? est constitu? par un tr?s
grand nombre d'yeux individuels en forme de b?tonnets. Chez certaines esp?ces
ils peuvent se composer d'un maximum de 30000 yeux individuels (Gonella, 1999).
Chez les esp?ces dont l'oeil compos? peut bouger sur un p?doncule, une
vision panoramique s'av?re possible, comme par exemple chez les squilles.
En ce qui concerne ces derni?res, il est aussi rapport? qu'elles peuvent
reconna?tre des couleurs jusqu'? une zone de 350 nm (Herzer 2003).
* L'odorat, le toucher et la reconnaissance des vibrations
Les cellules sensorielles relatives ? ces caract?ristiques se d?veloppent
? partir des sensilles. Des r?cepteurs chimiques se situent comme une grande
ouverture au bout d'un poil sensoriel ou sous forme de nombreux pores minuscules.
Les r?cepteurs m?caniques peuvent ?tre form?s comme des poils mobiles,
? la base desquels s'approche le cil d'une cellule sensorielle.
Une alternative est constitu?e par le d?veloppement d'un organe scolopodal
(scolopide). Les organes scolopodaux sont constitu?s par la fusion de cellules
sensorielles individuelles profond?ment enfonc?es sous la peau. Les organes
scolopodaux sont plac?s en s?rie dans le tronc, les extr?mit?s et les
membres tactiles. Pression, traction et vibration constituent les excitations
ad?quates. A ce sujet il ne faut pas oublier la perception de la pesanteur.
Les organes statiques sont souvent plac?s dans des petites fosses situ?es
? la base de la premi?re antenne. Elles sont rev?tues par la cuticule et
portent une bande garnie de poils sensoriels et de statholites. En fonction
de la longueur corporelle, les poils sont charg?s et fournissent l'information
concernant la position momentan?e. Lors de chaque mue les statholites (lest
corporel) doivent ?tre renouvel?s ce qui se fait soit par formation particuli?re
ou aussi par l'incorporation d'un corps ?tranger. Apr?s chaque mue de nombreuses
crevettes placent un petit grain de sable ou un autre objet appropri? dans
l'ouverture pr?vue ? cet effet (Gonella, 1999)
 |
| Mue (Enoplometopus debelius) |
Mue
Chez les crustac?s la mue constitue la seule possibilit? de croissance et
de r?g?n?ration des membres perdus. Pour cela la peau reliant la carapace
et l'abdomen est dissoute. Par mouvement du corps entier le crustac? s'extrait
par l'ouverture cr?e. Au cours de ce stade il peut grandir et r?g?n?rer
ses membres durant une courte p?riode. Cependant durant cette p?riode, et
ce durant dix jours, le crustac? est tr?s vuln?rable (la carapace n'a durci
qu'au bout de cette p?riode) car il n'a pas de protection envers ses agresseurs
et ses cong?n?res. Durant la mue se produisent ainsi de nombreuses mutilations
(mais il existe aussi d'autre raisons). L'?ge des animaux grandissant la
p?riode entre les mues s'allonge. Le processus de la mue n'est pas encore
compl?tement d?chiffr?. Actuellement des scientifiques examinent les m?canismes
de contr?le neuroendocriniens. En relation avec cela sont ?tudi?s les neuropeptides,
les peptides hormonales et les prot?ines myotropes de stimulation (petides)
Pas moindre est l'int?r?t des peptides neuro- et myoinhibiteurs sous forme
d'allatostatines. De tels peptides jouent un r?le essentiel dans la mue,
le contr?le des battements du c?ur et la contraction du rectum (Frische
2003)
La famille Hippolytidae (Bate, 1888)
C'est la famille la plus populaire de l'aquariophile marine.
La famille Hippolytidae a re?u le nom de ''crevettes nettoyeuses'' (par exemple Debelius 2000), parce que la plupart (peut ?tre tous) le membres du genre Lysmata sont des nettoyeuses de poissons. Il s'agit surtout de Lysmata amboinensis, qui a contribu? ? donner sa popularit? ? son genre. Toutefois certains repr?sentants de la famille des Palaemonidae (par exemple Urocaridella, Leandrites, Periclimenes) et des Stenopodidae (Stenopus) appartiennent aussi ? cette clique de nettoyeurs ? l'int?rieur de l'?norme ordre des D?capodes. Sous la propri?t? du nettoyage il faut comprendre que les crevettes qui pratiquent ce comportement lib?rent les poissons de parasites, de tissus n?cros?s ou de restes de nourriture dans la bouche (par exemple entre les dents), dans les fentes branchiales ou sur le corps entier. Afin que ce comportement fonctionne les crevettes nettoyeuses habitent la partie pr?cise d'une zone r?cifale, dans laquelle les poissons se retrouvent, pour y solliciter les soins des crevettes.
Il y a peu l'ordre Decapoda faisait partie du sous-ordre Natantia (crevettes). Une classification qui fait place de nos jours ? une segmentation en divers Infraordres. Ainsi la Famille Stenopidae fait partie de l'Infraordre Stenopodidea, tandis que la Famille Hippolytidae est rattach?e ? l'Infraordre Caridea.
Le
genre Lysmata
Il faut citer les esp?ces Lysmata amboinensis et Lysmata debelius,
qui sont r?guli?rement disponibles dans le commerce sp?cialis? et ainsi
connues de tous les aquariophiles.
Habitat naturel et mode de vie
Les esp?ces du genre Lysmata ont aussi bien conquis comme biotope
les r?cifs tropicaux que les eaux chaudes temp?r?es de l'Atlantique et
du Pacifique. En font partie Lysmata seticaudata, Lysmata nilita,
Lysmata californica et Lysmata wurdemanni. Tous les membres
ont un mode de vie cach?, qui les engage ? passer leur vie surtout entre
des formations rocheuses, sous des tombants, dans des grottes ou sous des
pierres, ou entre les fentes qui forment le r?cif. Quelques-unes d'entre
elles ont conquis les ?ponges (par exemple Lysmata wurdemanni) ou des algues
comme biotope.
Certaines esp?ces sont principalement diurnes, ce qui en fin de compte d?rive
de leur activit? de nettoyage. La science admet que toutes les esp?ces du
genre Lysmata se nourrissent en partie en nettoyant les poissons. Ainsi
Debelius (2000) rapporte que des crevettes nettoyeuses de la famille Hippolytidae
sont connues, surtout les grandes, pour lib?rer des poissons r?cifaux stationnaires
comme les mur?nes et les m?rous de parasites, de lambeaux de peau et de
tissus n?cros?s.
Par rapport ? cela, il faut surtout remarquer que Lysmata amboinensis
rend ses services avec une ardeur sans pareille. Debelius (2000) cite la crevette
nettoyeuse ? bande blanche comme un des plus importants invert?br?s nettoyeurs
pour les poissons r?cifaux. Elle ne se restreint pas uniquement au nettoyage
des zones corporelles externes de leur h?te mais elle grimpe m?me dans la
cavit? buccale de leurs clients pr?dateurs afin d'?liminer les restes de
nourriture entre leurs dents. Jamais les m?choires ne se refermeront sur
un aide symbiotique pour le manger (Debelius 2000). Toutefois Nahke (1998)
consid?re la protection des crevettes contre la pr?dation de mani?re plus
diff?renci?e. Ainsi il a pu constater que les poissons qui sont justement
nettoy?s par les crevettes montrent une inhibition totale de consommation,
que par contre des poissons qui ne sont pas nettoy?s essayaient de capturer
les crevettes. Ainsi certains labres comptent parmi les chasseurs de crevettes.
L'activit? de nettoyage ne repr?sente nullement une protection absolue contre
la pr?dation. Ceci explique le mode de vie cach? des crevettes nettoyeuses
sans d?fense.
 |
| Lysmata amboinensis nettoyant Pomacanthus asfur |
Mais
comment fonctionne la communication entre crevettes et poissons ? Nous savons
que les poissons nettoyeurs (Labroides spp.) s'approchent de leur h?te
avec une nage typique. Nahke (1998) cite les antennes bien visibles comme
signe de reconnaissance. Surtout les antennes blanches comme celles des esp?ces
Lysmata amboinensis, Stenopus hispidus ou Periclimenes pedersoni
doivent ?tre nomm?es comme exemple. Cette hypoth?se est soutenue par les
donn?es de Bauer (2000), qui d?finit Lysmata amboinensis et Lysmata
grabhami comme nettoyeuses obligatoires de poissons, par contre caract?rise
Lysmata seticaudata, L. nilita et L. wurdemanni (elles
portent des antennes de couleur rouge) comme crevettes nettoyeuses facultatives.
Bien que Patzner (1982 dans Bauer 2000) rapporte avoir rencontr? des rassemblements
en groupes de Lysmata seticaudata en eau peu profonde en compagnie
de mur?nes dans des grottes. Une observation qui a aussi ?t? effectu?e
par Limbaugh et al. (1961 dans Bauer 2000) pour Lysmata californica.
En relation avec cela, il faut signaler l'observation de Limbaugh et al. (1961
dans Bauer 2000), que outre les poissons Lysmata californica nettoye
?galement le corps des langoustes.
En ce qui concerne le mode de vie communautaire des esp?ces du genre Lysmata
avec les mur?nes, Bauer (2000) constate toutefois que les crevettes font
partie de leur sch?ma alimentaire et sont consomm?es par celles-ci d?s
que l'occasion se pr?sente. Il en d?duit que les crevettes utilisent le
corps des mur?nes comme source de nourriture compl?mentaire et qu'elles
les paissent ? la recherche de quelque chose de consommable; ceci n'a pourtant
rien ? voir avec le comportement symbiotique de nettoyage.
Outre le mode de vie stationnaire des crevettes nettoyeuses, au cours de laquelle
le poisson remarque rapidement qu'il peut de nouveau avoir recours au soins
de nettoyage, ce sont par cons?quent les longues antennes de couleur blanche
en forme de fouet qui fonctionnent comme signe de reconnaissance entre le
poisson et la crevette. S'y rajoute la couleur et le dessin remarquable du
corps ainsi qu'un mouvement du corps qualifi? de balancement (Bauer 2000,
Frische 2003)
 |
| Lysmata rathbunae |
Le
comportement social
Bauer (2000) s'est occup? de mani?re intensive avec le mode de vie social
des esp?ces de Lysmata et est arriv? ? la conclusion selon laquelle
il est possible de classer les esp?ces examin?es en deux groupes. Les Lysmata
seticaudata, L. wurdemanni et L. californica d'activit?
cr?pusculaire ou nocturne vivent en rassemblements importants, tandis que
les Lysmata grabhami, Lysmata amboinensis et Lysmata debelius
surtout diurnes pr?f?rent une vie en couple. Le fait de savoir, si les observations
de Debelius (1984) concernant la concentration en groupe des Lysmata debelius
et aussi des Lysmata amboinensis est ?galement valable pour les juv?niles,
reste sans r?ponse et Bauer (2000) r?sume en affirmant que la cat?gorisation
qu'il a faite m?rite un examen plus approfondi.
A ce sujet la corr?lation entre l'activit? obligatoire de nettoyage lorsque
les crevettes vivent en couple, et le comportement nettoyeur facultatif lorsque
les crevettes sont rencontr?es en rassemblement (Bauer 2000) est int?ressante.
S'y rajoute la constatation selon laquelle les crevettes nettoyeuses facultatives
sont plut?t nocturnes et les crevettes nettoyeuses obligatoires pr?f?rent
le jour pour leur activit?.
Caract?ristiques sexuelles
Bauer (2000) ne d?crit pas moins de six syst?mes sexuels possibles au sein
de l'infraordre Caridea:
Ontog?n?se du syst?me sexuel (D?veloppement)
1) Gonochorististique (sexuellement s?par?) ——› juv?nile
—› M?le primaire
![]() Juv?nile —›
Femelle primaire
Juv?nile —›
Femelle primaire
2) Protandrie simple (Masculinit?) ———————›
juv?nile —› Phase M?le —› Phase Femelle
3) Protandrie (avec phase femelle primaire) ——› juv?nile —›
Phase m?le —› Phase femelle
![]() Juv?nile —›
Phase femelle primaire
Juv?nile —›
Phase femelle primaire
4) Protandrie (avec phase femelle pr?coce) ——› juv?nile —›Phase
m?le —›Phase femelle
![]() Phase femelle "pr?coce"
Phase femelle "pr?coce"
![]() Juv?nile —›
Phase femelle primaire
Juv?nile —›
Phase femelle primaire
5) Protandrie (avec phase m?le primaire) ——› juv?nile —›
Phase m?le —› Phase femelle
![]() Juv?nile —›
M?le primaire
Juv?nile —›
M?le primaire
6) Protandrie simultan?e ![]() ——›
Juv?nile —› Phase m?le —› Phase femelle
——›
Juv?nile —› Phase m?le —› Phase femelle ![]() (Hermaphrodisme
simultan?)
(Hermaphrodisme
simultan?)
![]() Hermaphrodisme
Hermaphrodisme ![]() D?veloppement
exclusif en m?le (?)
D?veloppement
exclusif en m?le (?)
Les membres du genre Lysmata sont consid?r?s comme des hermaphrodites protandriques
(changement de femelles en m?les)
Spitschakoff (1912 dans Bauer 2000) a d?j? signal? ? propos de Lysmata
seticaudata, qu'il a pu identifier en m?me temps lors d'examens histologiques
des organes de reproduction aussi bien les gonades femelles que m?les et
ceci ind?pendamment de la taille des animaux examin?s. Spitschakoff a d?duit
de ses ?tudes qu'il s'agit chez Lysmata seticaudata d'hermaphrodites
protandriques, qui sont d'abord de sexe masculin qui change ensuite en fonction
de la taille et de l'?ge vers le sexe f?minin (Baldwin & Bauer 2003)
Le premier rapport concernant l'hermaphrodisme simultan? de l'un des membres
de l'infraordre Caridea se trouve chez Kagwade (1982 dans Bauer 2000). Celui-ci
d?crit Exhippolysmata ensirostris (Kemp, 1914) comme hermaphrodite
simultan?. ?tant donn? qu'aucune exp?rimentation concernant le d?veloppement
de la maturit? sexuelle n'a ?t? effectu?e par Kagwade et que ses affirmatuions
se restreignaient sur le fait qu'il avait trouv? chez des soi-disant femelles
des canaux d?f?rents et du sperme, l'hermaphrodisme simultan? est rest?
une hypoth?se, qui a surtout ?t? propag?e dans les revues aquariophiles.
Seul Fiedler (1998) a prouv? l'hermaphrodisme simultan? chez Lysmata
amboinensis.
Bauer & Holt (1998) ont ?tudi? le comportement d'accouplement chez Lysmata
wurdemanni. Par des vid?os ils ont document? la copulation entre les
animaux, qui se trouvaient dans la phase femelle. Ce sont les m?les qui ?taient
actifs, en tant qu'animaux plus petits.
Selon Bauer (2000) la preuve d'un hermaphrodisme simultan? protandrique se
trouve chez Lysmata amboinensis, Lysmata debelius et Lysmata
wurdemanni. Chez Lysmata seticaudata, L. nilita, L. californica
et L. grabhami cette capacit? est suppos?e. Jusqu'? pr?sent la
protandrie est d?montr?e chez ces esp?ces. La question qui se pose est
l'utilit? et le co?t de cette forme de changement de sexe.
L'avantage de la protandrie est constitu? par le fait que les petites crevettes
n?cessitent moins d'?nergie afin de produire suffisamment de sperme. Il
est par cons?quent sens? que les individus les plus grands entreprennent
en premier lieu la production plus riche en ?nergie des ovules. S'y ajoute
l'incubation des ?ufs sur une p?riode d'environ 14 jours, laquelle n?cessite
?galement de l'?nergie.
Jusqu'? pr?sent la question concernant l'avantage de l'hermaphrodisme simultan?
protandrique n'est pas ?claircie. L'une des hypoth?se veut que l'?tat de
la vitalit? est l'inducteur du sexe. Des animaux robustes et en bonne sant?
sont plus capables de produire les ?ufs exigeants en?nergie que des animaux
maladifs ou ?g?s.
A la fin de son rapport Bauer (2000) acquiesce avec l'?volution de l'hermaphrodismes
simultan? protandrique chez le genre Lysmata. Comme l'un des m?canismes
de ce comportement sexuel il cite en priorit? la faible densit? de population.
La n?cessit? est soutenue par le comportement territorial des crevettes
nettoyeuses, qui n'ont pas la possibilit? lors de la perte du partenaire
d'aller chercher un nouveau compagnon ad?quat. Ainsi Wirtz (1972 dans Bauer
2000) a pu observer que certaines Lysmata grabhami, qui avaient ?t?
isol?es de leur an?mone protectrice, devenaient rapidement la proie de pr?dateurs.
Pour quelle raison cependant Lysmata wurdemanni apparaissant en communaut?
importante est un hermaphrodite simultan? protandrique ne peut pas ?tre
d?duit des conditions d?crites et reste sans r?ponse.
A propos de la maintenance en aquarium
La maintenance de Lysmata dans un aquarium d'eau de mer a d?j? eu
lieu d?s les ann?es 70. A cette ?poque la crevette nettoyeuse ? bande
blanche connue actuellement comme Lysmata amboinensis s'appelait Hippolysmata
grabhami. Frank de Graaf (1969) renvoie ? la maintenance facile de Hippolysmata
grabhami et Stenopus hispidus dans l'aquarium et donne comme esp?rance
de vie dans l'aquarium rarement plus de deux ann?es, ce qu'il consid?re
toutefois comme ?lev?.
Wilkens (1973) s'int?resse ?galement ? la maintenance d'Hippolysmata
grabhami et atteste de la maintenance facile de cette crevette. Dans les
conditions de l'?poque il arrivait ? Wilkens de maintenir ses animaux durant
3 ann?es, diagnostiquant en m?me temps une dur?e de vie appr?ciable. De
nos jours nous savons par exemple que Stenopus hispidus peut atteindre
dix ans dans un aquarium r?cifal (Frische 2003). Lysmata amboinensis atteint
g?n?ralement une dur?e de vie de plus de 5 ann?es dans un aquarium peupl?
de coraux fonctionnant correctement (Frische obs. personnelle). Les ?ges
cit?s se r?f?rent ? des crevettes qui ont ?t? acquises comme juv?niles
d'une longueur corporelle d'anviron 3 cm. D'apr?s mes estimations la raison
d?terminante pour cet ?ge consid?rable des crevettes en aquarium est constitu?
par l'am?lioration des conditions de vie qu'un aquarium r?cifal offre de
nos jours.
- Conditions de vie optimales
Afin que les crevettes atteignent un ?ge biblique dans l'aquarium r?cifal,
l'introduction dans le nouveau biotope artificiel est d?j? d'une signification
d?cisive. Les crevettes r?cemment acquises doivent ?tre adapt?es avec
beaucoup de d?licatesse ? l'eau de l'aquarium. En r?gle g?n?rale ceci
s'effectue par la m?thode du goutte ? goutte. L'eau de l'aquarium goutte
dans l'eau de transport. Cette proc?dure s'?tend sur une certaine p?riode,
laquelle est n?cessaire pou m?langer la moiti? de l'eau de transport avec
l'eau de l'aquarium. Ensuite on proc?de au transfert de la crevette vers
l'aquarium.
L'?change de l'eau doit s'effectuer lentement, car la cuirasse de la crevette
ne permet pas un ajustage rapide des modifications osmotiques de l'eau environnante
avec le fluide corporel. Si cette adaptation ? l'eau de l'aquarium s'effectue
trop rapidement les cellules corporelles ne sont pas capables de compenser
? leur vitesse les diff?rentes teneurs en sel. Selon la densit? de l'eau
environnante elles explosent ou r?tr?cissent. Il en r?sulte une crevette
qui chute vers le sol, dont les antennes se d?forment en forme de tire-bouchon.
Le corps prend la forme d'une demi lune. Afin que les crevette muent en permanence
et poursuivent ainsi leur croissance, il est essentiel de maintenir la quantit?
de nitrates et de phosphates du milieu dans des concentrations optimales.
En quantit?s trop importantes les deux param?tres cit?s influencent de
fa?on n?gative le processus de la mue et conduisent ? ce que les animaux
ne peuvent plus se lib?rer compl?tement de l'exuvie et meurent. ?tant donn?
que les coraux ne supportent pas non plus en quantit?s trop importantes les
nutriments cit?s, l'aquariophile fait attention de nos jours ? ce que les
concentration id?ales soient stables en utilisant des filtres de d?nitrification
et des adsorbeurs de phosphates (Frische 2003). L'apport r?gulier d'oligo-?l?ments
tels que le strontium, l'iode, le calcium et le magn?sium ainsi que les changements
d'eau r?guliers contribuent au bien-?tre des crevettes.
- Les associations
Wilkens (1980 / 1987) d?crit une exp?rience concernant Hippolysmata grabhami
v?cue lors d'une plong?e. Il a observ? 5 animaux de cette esp?ce qui vivaient
sous une colonie morte d'Acropora et l'auteur se r?jouissait de voir
comment elles nettoyaient des Anthias (Remarque : dans ce cas il s'agissait
de Lysmata amboinensis). D?j? ? cette ?poque Wilkens (1980 / 1987)
faisait allusion ? la capacit? d'hermaphrodisme protandrique de Hippolysmata
(Lysmata) grabhami et met en cause l'avis scientifique av?r?
selon lequel les juv?niles de cette esp?ce sont d'abord m?les puis femelles,
car il a pu observer que des soi-disant m?les adultes assument la part masculine,
en cas de besoin. Une s?rie d'exp?rimentations ont ensuite prouv? le r?sultat
de l'hermaphrodisme simultan? protandrique.
Les r?sultats obtenus par Wilkens (1980 / 1987) proviennent d'observations
effectu?es en aquarium. Les crevettes ont ?t? maintenues en aquarium r?cifal.
Il est possible de constater qu'une bonne maintenance dans des conditions
similaires ? celles de la nature rend possible un comportement naturel et
que des r?sultats plausibles peuvent r?sulter d'observations effectu?es
en aquarium.
Wilkens (1980 / 1987) a ?galement pu montrer en aquarium que la crevette
nettoyeuse ? bande blanche pr?f?re la vie en couple.
En consid?rant l'habitat normal des esp?ces de Lysmata, il est ?vident
qu'il faut maintenir ces ep?ces dans des aquariums riches en pierres, ?
structures multiples, formant quelques grottes et niches. Les crevettes s'y
retirent et y pr?sentent un comportement naturel. Elles s'approchent des
poissons de mani?re typique et les nettoient de la m?me mani?re que dans
la nature. Cependant elles ne se nourrissent pas exclusivement des produits
des services de nettoyage, mais consomment tout ce qui peut ?tre distribu?
comme nourriture animale. Les aliments en paillettes de toute sorte en faisant
partie.
On peut souvent lire que Lysmata amboinensis doit ?tre maintenue en
groupe (par exemple B. Baensch & Debelius 1992, Foss? & Nilsen 1998, Frische
2001). Que cela constitue vraiment le comportement naturel ne peut pas ?tre
affirm? de fa?on absolue, car souvent il est fait allusion ? la vie en
couple (Wilkens 1987, Baensch & Debelius 1992, Fiedler 1998, Bauer 2000).
A l'oppos? il y a des donn?es selon lesquelles Lysmata amboinensis
a ?t? rencontr?e en groupe de plusieurs centaines (Debelius 1984, Baensch
& Debelius 1992). Les observations que j'ai pu faire en aquarium permettent
au moins de conclure que la maintenance d'un groupe de Lysmata amboinensis
ne pr?sente pas d'inconv?nient. Maintenir les Lysmata debelius ?
plusieurs est d?j? plus difficile, car cette esp?ce adopte plus cons?quemment
le mode de vie en couple que ses proches parentes. Les autres esp?ces de
Lysmata rencontr?es dans le commerce peuvent ?tre maintenues en groupe.
L'association avec des poissons aux m?urs pr?datrices pr?sente un risque
in?gal. Le poisson com?te (Calloplesiops altivelis), la plupart des
poissons-faucon (Familie: Cirrhitidae), quelques labres (comme les genres:
Thalassoma ou Coris), les poissons-lions (genre: Pterois)
ou les poissons Hamlet (Genre: Hypoplectrus) en veulent ? la vie des
crevettes sans d?fense (Frische 2003) A mon avis c'est surtout la couleur
corporelle rouge qui fait le malheur des ces animaux dans l'aquarium. Alors
que dans la nature, dans le biotope naturel, la couleur rouge apparait grise
? partir d'une profondeur de 3 m?tres, la m?me couleur a un effet voyant
dans l'aquarium et est ainsi remarquable ayant l'effet contraire de la protection.
Mais pas seulement les poissons en veulent ? la vie des crevettes nettoyeuses.
De ci et de l?, il est rapport? que Stenopus hispidus consid?rent
les crevettes sans d?fense comme nourriture (Hebbinghaus 2003)
Pour terminer consid?rons l'association avec les invert?br?s. Ceux-ci n'ont
en r?gle g?n?rale rien ? craindre des crevettes du genre Lysmata,
except? les petits vers tubicoles du genre Spirobranchus. Assez souvent
Lysmata amboinensis a ?t? surprise ? la lueur de la lumi?re bleue
en tirant les vers de leurs tubes pour ensuite les consommer. La raison pourrait
en ?tre un opercule recouvert d'algues, qui ne peut plus ?tre compl?tement
referm? par le vers tubicole permettant ainsi aux crevettes d'acc?der ?
cette nourriture app?tissante.
- Possibilit?s d'?levage des crevettes nettoyeuses en aquarium
Les efforts de multiplication des esp?ces de Lysmata en aquarium ne
sont pas r?centes (Wilkens 1980, Spies 1987)
 |
 |
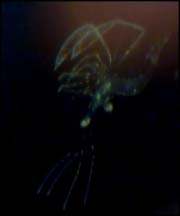 |
 |
| Reproduction de Lysmata amboinensis(avec l'aimable autorisation de Oliver Forster) | |||
Comme
signal? il est tr?s facile de maintenir un couple d'une esp?ce de Lysmata
capable de se repoduire. En principe deux individus d'une esp?ce suffisent
pour garantir une production r?guli?re de jeunes. Le probl?me se situe
plut?t dans l'?levage.
Wilkens (1980) d?crit en tant que pionnier les essais d'?levage et les moments
de leur ?chec. L'engagement de multiplier les larves des crevettes nettoyeuses
ne doit finalement pas ?tre attribu? au fait que les larves semblent d?j?
relativement grosses lors de l'?closion. Il en est ainsi parce que toutes
les esp?ces de Lysmata s'occupent de leurs ?ufs d'abord sous leur
abdomen entre les parapodes et ne les lib?rent pas directement dans l'eau.
La dur?e de l'assistance est en moyenne d'environ 2 ? 3 semaines. Au cours
de cette p?riode l'?uf se d?veloppe en passant par le stade de zo? (larve)
jusqu'au stade Mysis auquel il est repouss? par les parents (Wilkens 1980).
Durant le processus de l'?mission des larves une ''barri?re'' emp?che les
parents de consommer leurs larves fra?chement lib?r?es (Frische 1999).
Au cours des premi?res semaines il faut approvisionner les larves dans l'aquarium
(comme dans la nature) avec du plancton. Le plus souvent les larves meurent
lors de la transformation en d?capodites ou lors des premi?res mues (Wilkens
1980) A mon avis la cause de la mort avant le stade de la m?tamorphose r?side
dans la carence en certains oligo-?l?ments ou/et de concentrations trop
importantes en substances nocives dues ? un exc?s de nourriture.
Simoes et al. (2002) ont examin? l'alimentation des stades pr?coces des
larves de la crevette de feu Lysmata debelius. La raison de la recherche
est constitu?e par le th?me complexe de l'?levage commercial pour la vente
d'esp?ces de crevettes attrayantes. Les scientifiques cit?s veulent d?terminer
s'il est possible de r?duire l'important taux de mortalit? des larves durant
les 96 premi?res heures. Il s'av?re que l'opinion tr?s r?pandue que les
crevettes fra?chement ?closes s'en sortiraient sans nourriture au cours
des 24 premi?res heures et se nourrissent plut?t des restes de leur sac
vitellin s'av?re fausse. D?j? quelques minutes apr?s l'?closion les scientifiques
ont pu enregistrer une prise de nourriture par les larves, surtout les micro-algues
propos?es. Ont ?t? nourries des nauplies d'Artemia salina et des micro-algues
Tetraselmis chuii, Rhinomonas reticulata et Sekeletonema
costata. Il a entre autres ?t? recherch? si la distribution des diverses
mico-algues en association avec les nauplies d'Artemia salina apportait
une am?lioration de l'augmentation de la taille entre les stades Z1- et Z2.
Comme Z1, Simoes et al. (2002) d?signent les larves zo? fra?chement ?closes,
comme Z2 est d?sign? le stade zo? ?g? de 48 heures (apr?s l'?closion).
Le temps total de recherche a dur? 96 heures apr?s l'?closion. Le taux
de survie a ?t? d?termin? apr?s cette p?riode (tout comme apr?s 72
heures). L'acc?l?ration de l'augmentation de la taille a ?t? d?termin?e
d'apr?s le nombre de mues entre Z1 et Z2.
Les scientifiques ont d?termin? lors de leurs exp?rimentations que les
larves de Lysmata debelius sont omnivores. A l'oppos? il y a les r?sultats
de LeVay et al. (2001 dans Simoes et al. 2002), qui attribuent aux larves
de Lysmata debelius un comportement alimentaire carnivore dans la nature.
Simoes et al. (2002) attribuent cette divergence aux diff?rences entre la
maintenance en aquarium et l'alimentation dans la nature. La distribution
simultan?e de nauplies d'Artemia et de micro-algues Tetraselmis chuii
ont permis l'am?lioration du taux de survie des larves. Les scientifiques
attribuent cela aux propri?t?s antibact?riennes sp?cifiques de ces micro-algues.
Cette affirmation est soutenue par un examen de von Misciattelli et al. (1998
dans Simoes et al. 2002). Ce groupe de travail a transf?r? de l'eau dans
un aquarium d'?levage, dans lequel avait auparavant ?t? ?lev?s des Tetraselmis
chuii. Les larves de la crevette fouet Fenneropenaeus (Penaeus)
indicus ont ?t? ?lev?es dans cet aquarium d'?levage. Seul l'apport
d'eau sans micro-algues a augment? le taux de survie des larves de l'esp?ce
cit?e de fa?on significative.
 |
 |
 |
 |
| Reproduction réussie de Stenopus sanzibariensis(avec l'aimable autorisation de Iris B?nig) | |||
Une acc?l?ration significative de l'augmentation de la taille et le d?veloppement
des larves de Lysmata debelius du satde Z1 au stade Z2 ont ?t? atteints,
lorsque Artemia salina a ?t? distribu? simultan?ment avec ces trois
esp?ces de micro-algues. S'il y aura finalement plus de Lysmata debelius,
ne trouve pas sa r?ponse dans la publication de Simoes et al. (2002). Mais
la conclusion de ce travail est repr?sent?e par une augmentation significative
du taux de survie de larves au stade pr?coce de Lysmata debelius qui
peut ?tre obtenue en distribuant dans l'eau d'?levage des crevettes une
association d'Artemia salina et de micro-algues Tetraselmis chuii directement
apr?s l'?closion.
La m?me chose de ce qui vient d'?tre rapport? ici devrait ?tre valable
pour Lysmata amboinensis, ?tant donn? que l'?levage r?gulier de
cette crevette nettoyeuse en grand nombre constitue ?galement un ?v?nement
exceptionnel. Par contre Lysmata wurdemanni est reproduite tout ?
fait r?guli?rement et en grand nombre (Debelius 2000). Concernant l'?levage
de Lysmata wurdemanni sans nourriture vivante on trouve des choses
int?ressantes chez Delbare (2003). Dans cet article il y a aussi une liste,
m?me si incompl?te, des publications actuelles d'?levages r?ussis de diverses
esp?ces de Lysmata.
Entre temps une autre esp?ce de Lysmata sp. a ?t? ?lev?e (B?nig 2005)
 |
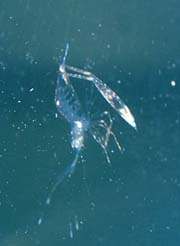 |
 |
 |
| Protozoea-Stadium
Feeding: Brachionus and Copepoden (conditioned with CultureSelco 3000) |
Zoea-Stadium
Feeding: Nauplia of Artemia salina (conditioned with CultureSelco 3000) |
Postlarvale-Phase
Feeding: Nauplia of Artemia salina (conditioned with CultureSelco 3000) |
Juvenile
Shrimp Feeding: Standard feeding |
Les efforts intensifs des scientifiques concernant ce th?me laissent supposer
que l'?levage des esp?ces du genre Lysmata feront bient?t partie
des travaux de routine d'une station commerciale d'?levage.
 |
| Stenopus cyanoscelis |
La
famille Stenopodidae (crevettes ? pinces)
La famille des crevettes ? pinces est surtout repr?sent?e par le genre
connu des aquariophiles sous le nom scientifique de Stenopus. Moins
connu semble ?tre le genre Microprostema (Debelius, 2000).
A l'int?rieur du genre Stenopus se trouvent quelques repr?sentants
qui arrivent r?guli?rement chez nos commer?ants. Les crevettes ? pinces
se distinguent essentiellement par six antennes extr?mement longues et deux
pinces puissantes. Les pinces fonctionnent entre autre comme un instrument
de d?fense, ce qui fait qu'elles peuvent ?tre associ?es aux poissons qui
mangent des crevettes. Les crevettes ? pinces sont extr?mement timides et
limitent en r?gle g?n?rale leur activit? aux heures cr?pusculaires ou
nocturnes. Ainsi de nombreuses crevettes ? pinces peuvent ?tre mieux observ?es
sous la lueur d'un ?clairage bleu. Les sexes sont s?par?s. Outre la r?partition
sexuelle s'ajoute un comportement territorial prononc? qui fait que de nombreuses
esp?ces de Stenopus ne peuvent ?tre maintenues qu'en couple. Les
attaques contre d'autres animaux ? carapace ne se limitent pas seulement
aux cong?n?res de m?me sexe mais aussi contre les crevettes de forme et
de couleurs similaires. Dans les aquariums des commer?ants des querelles
se produisent souvent qui ont la perte d'une pince comme cons?quence. La
perte des extr?mit?s (ce qui peut aussi se produire chez les esp?ces de
Stenopus lors de la r?union de m?les et de femelles) est en g?n?ral peu
probl?matique pour les crustac?s et les crevettes, car elles peuvent ?tre
r?g?n?r?e lors de la prochaine mue - m?me si pas imm?diatement de taille
identique. Trois ? quatre mues plus tard toutefois, plus rien ne rem?more
l'ancienne perte (Gehrmann, 1999)
Les crevettes ? pinces nettoient les poissons. Cependant ce service n'est
pas aussi intensif et ?tendu que chez le genre Lysmata.
 |
| Stenopus hispidus (Photo Marcel Staebler) |
La
raison de la diminution de l'activit? de nettoyage en aquarium n'est pas
connue. De temps ? autre on peut observer que les actions de nettoyage chez
les petits poissons sont si intenses que les poissons sont aval?s en m?me
temps (Frische 1992, Schuhmacher & Hinterkircher 1996, Heerz 1998, Knop 2001).
Une incongruit?, qui ? mon avis, est certainement restreinte ? la maintenance
en aquarium. Des attaques contre Lysmata amboinensis ont ?t? observ?es,
qui en cas de manque de nourriture et d'aquarium trop petit ont men? ? la
mort de la Lysmata (Foss? & Nilsen, 1998, Hebbinghaus 2003)
L'alimentation avec des tablettes congel?es et des comprim?s est facile
? satisfaire, si bien qu'il est possible de qualifier leur maintenance en
aquarium comme sans probl?me. L'esp?ce la plus connue des crevettes ? pinces
est Stenopus hispidus, qui ? peu de choses pr?s a sa place dans les
aquariums depuis le d?but de l'aquariophilie marine. Avec une longueur de
5 cm elles peuvent atteindre l'?ge de 9 ans (Finck, com. personnelle)
La vie en communaut? de Stenopus hispidus constitue le probl?me le
plus important en ce qui concerne cette esp?ce. Comme Gro?kopf (1992) le
signale, il est difficile de maintenir plus d'un couple dans des aquariums
de taille moyenne. Des aquariums de plus de 1000 litres permettent l'association
de deux couples. Comme si cela ne suffisait pas, Stenopus hispidus
consid?re les autres crevettes ? pinces comme des intrus et les attaque
avec v?h?mence et sans piti?. Les esp?ces du genre Lysmata sont
?galement sans d?fense face ? Stenopus hispidus. Les autres esp?ces
du genre Stenopus import?es de temps ? autre ne sont pas aussi territoriales.
Ceci est peut ?tre en rapport avec la taille finale qu'elles peuvent atteindre
laquelle est nettement plus petite que celle de l'esp?ce Stenopus hispidus.
 |
| Alpheus bellulus |
La
famille Alpheidae (crevette pistolet)
Au cours des derni?res ann?es la popularit? des repr?sentants de la famille
des crevettes pistolet (Lange & Kaiser 1991, D?rbaum 1999) a fortement augment?.
Si ? la fin des ann?es 80, il y avait peu de renseignements concernant la
vie en aquarium de ces crevetes passionnantes, ceci a fondamentalement chang?
avec l'aquariophilie r?cifale. Tr?s rapidement on reconna?t que parmi les
crevettes pistolet il n'y a pas seulement des crevettes consommant des poissons
(Lange & Kaiser, 1991), qui utilisent leurs pinces ? effet surdimensionnel
comme outil pour chasser de petits poissons, mais d'int?ressants crustac?s
qui communiquent entre eux en ?mettant une d?tonation ? l'aide d'une de
leur pince agrandie et qui se d?fendent aussi ? l'aide de celle-ci.
Les crevettes pistolet se caract?risent par deux particularit?s de leur
structure corporelle. D'une part chez celles-ci les yeux sont cach?s sous
le c?phalothorax. Cela sert ? la protection des yeux, ?tant donn? que
ces crevettes se sont appropri?es leur biotope dans des grottes et tuyaux.
Des yeux p?doncul?s ne constitueraient qu'un handicap avec un tel mode de
vie et ils seraient sujets ? des blessures. L'adaptation ? une forme de
vie particuli?re a une influence certaine sur la capacit? visuelle de l'animal.
Si la plupart des d?capodes peuvent parfaitement observer leur environnement
avec leurs yeux, les crevettes pistolet r?agissent d'apr?s le reflet clair
et sombre (Fossa & Nilsen, 1998).
La deuxi?me caract?ristique de la famille des Alpheidae est constitu?e
par les pinces de forme particuli?re, avec lesquelles les crevettes peuvent
cr?er des sons perceptibles ressemblant ? des coups de pistolet. La construction
de ces pinces cr?atrices de d?tonations, pouvant atteindre une longueur
de 3 cm, se compose d'une esp?ce de bouchon arrondi sur la partie mobile
de la pince (dactylus), qui correspond exactement ? une fosse profonde et
ronde de la partie fixe de la pince. La fermeture rapide des deux moiti?s
de pinces engendre la d?tonation.

Ce principe fascine les chercheurs. Des prises de vues et des r?sultats fantastiques
ont ?t? publi?s entre autre par le groupe de chercheurs du Prof. Barbara
Schmitz de M?nich. Les chercheurs ont pu d?terminer ? l'aide de vid?os
? grande vitesse (400 ? 40500 images/seconde) que cette crevette ne mesurant
que cinq centim?tres pouvait r?unir sous l'eau ses pinces ? une vitesse
sup?rieure ? 100 km/h. Ceci cr?e un jet d'eau, dans lequel se forme une
bulle de cavitation. Cette petite bulle de gaz se d?place ? partir de la
pince et atteint une taille pouvant atteindre 3 millim?tres, avant qu'elle
n'implose avec une d?tonation nettement audible. Avec cette puissante onde
de choc l'animal ?tourdit sa proie, qui se compose surtout de vers, de petits
poissons et de crevettes. Le crustac? utilise par cons?quent les lois de
l'hydrodynamique pour la cr?ations de sons. A un m?tre de distance l'intensit?
du son atteint 200 d?cibels.
Outre l'?quipe du Prof. Schmitz un deuxi?me groupe de chercheurs de l'universit?
de Twente (Enschede) a pu observer que le gaz de la bulle qui s'effondre atteint
une temp?rature sup?rieure ? 5000? C et ?met un ?clair lumineux (Lohse
et al. 2001). Cet ?clair lumineux n'est pas visible par l'?il humain, car
il ne dure qu'un dix milliardi?me de seconde. Cette m?thode inhabituelle
permettant ? la crevette de cr?er de la lumi?re est d?sign?e sous le
nom de shrimpoluminescence. Elle se trouve en ?troite parent? avec la luminescence
pulsatrice des bulles de gaz dans l'eau, qui est caus?e par des ultrasons
et est d?sign?e comme sonoluminescence (Scharf 2001)

Les crevettes pistolet ont acquis la popularit? en aquariophilie r?cifale
? cause de leur association avec les gobies partenaires habitant le sol,
qui a ?t? d?crite la premi?re fois en 1941. D?rbaum (1999) a ?tudi?
la vie commune des deux groupes d'animaux ? partir de vid?os. Il s'agit
du genre Alpheus (dans ce cas les repr?sentants des groupes Brevirostris-
et Edwarsii), qui vivent surtout en communaut? avec les gobies symbiotiques
des genres Amblyeleotris et Cryptocentrus. La r?alisation de
cette communaut? de vie dans l'aquarium est relativement facile ? concr?tiser,
?tant donn? qu'aussi bien le gobie que la crevette sont faciles ? maintenir
en vie dans l'aquarium. De plus la r?alisation de cette symbiose ne n?cessite
pas d'aquariums volumineux. Ainsi un aquarium d'une taille moyenne (400 litres)
suffit ? satisfaire notre d?sir d'une maintenance commune du gobie et de
la crevette.
La communaut? de vie entre gobie et crevette se d?veloppe comme suit : tandis
que le gobie cherche de la nourriture, scrute les pr?dateurs et les concurrents,
la crevette est occup?e sans cesse ? r?parer et ? consolider le terrier.
Pendant que la crevette infatigable ne cesse de sortir du sable de l'habitat
avec sa pince ?largie en forme de pelle ou qu'elle d?gage le sous sol de
sa maison, elle garde en permanence le contact avec le corps du gobie avec
ses antennes. En cas de danger le gobie se r?fugie dans l'abri s?r suivi
de la crevette, qui a aussi ?t? pr?venue par l'interm?diaire du contact
corporel par les antennes. Une autre t?che qui incombe ? la crevette est
l'approvisionnement suffisante en oxyg?ne du terrier. Ceci est atteint par
l'Alpheus en battant ses appendices ventraux faisant ainsi circuler
l'eau ? travers la construction (D?rbaum 1999).
Comme cette symbiose s'?tablit d?j? au cours des premi?res phases du cycle
de vie des deux animaux selon D?rbaum (1999), il n'est pas ?tonnant que
la crevette et le poisson se mettent d'accord ? propos d'une s?rie de mod?les
de comportement de communication. Pour ce faire le corps et les nageoires
du gobie fonctionnent comme instrument de communication palp?s par les longues
antennes de la crevette ? le recherche d'informations.
 |
| Stonogobiops nematodes & Alpheus randalli |
La
communaut? de vie des deux groupes d'animaux se passe essentiellement sur
les parties sablonneuses des zones d'eau peu profonde. Le s?diment dans lequel
le terrier a ?t? creus? se compose de d?bris corallien ou de fine vase
marine. Une condition, qu'il faut remplir dans l'aquarium, si l'aquariophile
veut r?aliser cete symbiose int?ressante.
La raison de cette association ne se trouve finalement pas dans la mauvaise
vision des crevettes. La grotte elle-m?me est le plus souvent habit?e par
un gobie et un couple de crevettes ou l'inverse. De temps ? autre il y a
la preuve que des gobies vivent aussi parfois en couple dans la grotte. Dans
la nature les tubes d'habitation sont si proches qu'il est possible aux gobies
de localiser sans probl?me le partenaire ad?quat et de mener avec lui la
reproduction.
La n?cessit? vitale de cette association n'est pas d?termin?e. Dans l'aquarium
toutefois seule est possible la maintenance d'un partenaire symbiotique. Il
faut cependant poser la question de savoir s'il faut aspirer ? la maintenance
individuelle de gobies ou de crevettes pistolet (comme les poissons-clowns
sans an?mone). Frische (2001) et Finck & Frische (2004) renvoient par exemple
au comportement anormal du poisson-clown lorsque celui-ci est maintenu sans
partenaire convenable. Il est possible d'imaginer ce comportement non naturel
chez les gobies associ?s aux crevettes.
Toutes les crevettes pistolet ne sont pas associ?es avec des gobies. La plus
grande partie des crevettes pistolet vit avec des ?ponges ou d'autres groupes
d'animaux dans une relation commensale. Il existe m?me des crevettes pistolet,
qui sont compl?tement livr?es ? elles-m?mes. En r?gle g?n?rale les
crevettes pistolet m?nent une vie relativement cach?e, ce qui fait qu'on
entend plut?t qu'on ne voit ces animaux dans l'aquarium. Souvent il arrive
que les crevettes pistolet sont introduites inopin?ment avec des pierres
vivantes. Ainsi la d?tonation soudaine fait croire ? l'aquariophile qu'une
vitre de l'aquarium s'est bris?e - avec la diff?rence qu'il n'y a pas d'eau
qui s'?coule.
Les crevettes pistolet constituent un groupe de crevettes tr?s int?ressant,
qui pr?sente de nombreux types de comportement fascinants et qui est aussi
utile dans l'aquarium. Ainsi l'action de creusement typique constitue une
activit? bienvenue qui pourvoit ? ce que le sable reste toujours propre
et est enrichi en oxyg?ne.
Litt?rature
Anker, A. & Frische, J. (2004): Garnelen der Familie Hippolytidae.
Viel beachtete Sch?nheiten in Riff und Aquarium. Teil 1 bis 4. Das Aquarium
38(4-7).
Baensch, H. A. & Debelius, H. (1992): Meerwasser-Atlas Band 1. Mergus Verlag.
Melle. 1216 S.
Baldwin, A. P. & Bauer, R. T. (2003): Growth, survivorship, life-span, and
sex change in the hermaphroditic shrimp Lysmata wurdemanni (Decapoda: Caridea:
Hippolytidae). Marine Biology,
Bauer, R. T. & Holt, G. J. (1998): Simultaneous hermaphroditism in the marine
shrimp Lysmata wurdemanni (Caridea: Hippolytidae): an undescribed sexual system
in the decapod Crustacea. Marine Biology 132: 223-235
Bauer, R. T. (2000): Simultaneous hermaphroditism in Caridean Shrimps: a unique
and puzzling sexual system in the Decapoda. Journal of Crustacean Biology.
20(2): 116-128
B?nig, I. (2005): Die Nachzucht einer bisher unbeschriebenen Lysmata-Art.
Der Meerwasser-Aquarianer 9(1), 41
Debelius, H. (2000): Krebs-F?hrer Weltweit. Jahr Verlag. Hamburg. 322 S.
Debelius, H. (1983): Gepanzerte Meeresritter. Kernen Verlag. 120 S.
Debelius, H. (2000): Krebsf?hrer. Jahr Verlag GmbH & Co., 322 S.
Delbare, D. (2003). Lysmata wurdemanni - Zucht ohne Lebendfutter. Der Meerwasseraquarianer
7(1): 14-27
D?rbaum, J. (199): Eine Symbiose par excellence: Pistolenkrebse (Alpheidae,
Crustacea) und Grundeln (Gobiidae, Pisces) - Videobeobachtungen im Aquarium.
5. Internationales Meerwassersymposium. Optimierung der Pflegebedingungen.
Bochum.
Eibert, H. (1999): Nicht Feind sondern Freund - Korallenkrabben im Aquarium.
Der Meerwasseraquarianer 3(2), 4-7
Erhardt, H. & Baensch, H. A. (1998): Meerwasser Atlas Bd. 4. Mergus Verlag.
1214 S.
Erhardt, H. & Baensch, H. A. (2000): Meerwasser Atlas Band 5. Mergus Verlag.
1152 S.
Fiedler, G. C. (1998): Functional, simultaneous hermaphroditism in Female-Phase
Lysmata amboinensis (Decapoda: Caridea: Hippolytidae). Pacific Science 52(2):
161-169
Finck, H. & Frische, J. (2004): Die Familie Pomacentridae. Teil 3: Riffbarsche
aus der Gattung Amphiprion und Premnas. Das Aquarium 38(11),
Fossa, S. A. & Nilsen, A. J. (1998): Das Korallenriff-Aquarium. Band 6. Birgit
Schmettkamp Verlag. Bornheim. 592 S.
Frische, J. (1999): Erfolgreiche Nachzuchten im Meerwasseraquarium. Bede-Verlag.
Ruhmannsfelden. 136 S.
Frische, J. (2001): Ratgeber: Handbuch der Meeresaquaristik. Bede-Verlag.
Ruhmannsfelden. 160 S.
Frische, J. (2003): Ihr Hobby: Garnelen und Krebse im Meerwasseraquarium.
Bede-Verlag. Ruhmannsfelden. 80 S.
Gehrmann, S. (1999): Stenopus hispidus: Regeneration der Scherenbeine. DATZ
52(7), 58
Gellinger-Tunze, B. (1999): Zucht und Aufzucht von Garnelen. Beobachtungen
bei der Nachzucht der Blutstriemen-Putzergarnele. Das Aquarium 29(6), 32-33
Gonella, H. (1999): Krebse, Krabben und Garnelen im S??wasseraquarium. Bede-Verlag.
Ruhmannsfelden. 96 S.
Gro?kopf, J. (1990): Pr?chtige Zehnfu?krebse: Garnelen der Gattung Stenopus
im Aquarium beobachtet. Tetra International Nr. 101, 28-31
Hebbinghaus, R. (2003): Die Geb?nderte Scherengarnele. DATZ 56(7), 60-62
Herzer,
K. 2003. Farben im Meer. Das Aquarium. 37(1), 49-54
Knop, D. 2001. Stenopus - Scherengarnele. Die Koralle. 2(2), 47-50
K?kenthal, W. & Renner, M. 1982. Leitfaden f?r das zoologische Praktikum.
Gustav Fischer Verlag. 18. Auflage. 480 S.
Lin, J. & Zhang, D. (2001): Reproduction in a simultaneous hermaphroditic
shrimp, Lysmata wurdemanni: any two will do? Marine Biology, 139: 912-922
Lohse, D. & Schmitz, B. & Versluis, M. (2001): Snapping shrimp make flashing
bubbles. Nature 413, 477-478
Nahke, P. (1998): Tricks im Riff. Jahr Verlag. Hamburg. 160 S. Nr. 93, 29-30
Remane, A. & Storch, V. & Welsch, U. (1981): Kurzes Lehrbuch der Zoologie.
Gustav Fischer Verlag. Stuttgart. 540 S.
Samhuber, G. (1996): Und es geht doch - Lysmata debelius. DATZ 49(1), 34-35
Scharf, R. (2001): "Shrimpolumineszenz": Pistolenkrebs l?sst Luftblasen leuchten.
http://www.pro-physik.de
Schuhmacher, H. & Hinterkircher, J. (1996): Niedere Meerestiere. BLV. 320
S.
Simoes, F. & Ribeiro, F. & Jones, D. A. (2002): Feeding early larval stages
of fire shrimp Lysmata debelius (Caridea, Hippolytidae). Aquaculture international
10: 349-360.
Spies, G. (1987): Was habe ich nur falsch gemacht? Misserfolge mit Garnelennachzuchten.
TI Nr. 83, 25-26
Wilkens, P. (2. Auflage 1987): Niedere Tiere im tropischen Meerwasseraquarium
II. Engelbert Pfriem Verlag. Wuppertal. 456 S.
Wilkens, P. (2. erweiterte Auflage 1980): Niedere Tiere im tropischen Meerwasseraquarium.
Engelbert Pfriem Verlag. Wuppertal. 232 S.
