





Le cycle de l'azote
Par
Marco Pagni (microbiologiste)
MARS © Copyright 1998 -
All Rights Reserved
- J'ai tenté
ici d'un peu clarifier la chimie et la biologie des composés azotés. J'ai
commis quelques simplifications et schématisations que les spécialistes
voudront bien me pardonner. J'ai préféré aller à l'essentiel... de mon
point de vue de microbiologiste. J'ai fait appel à quelques notions de
physiologie microbienne, qui sont inhabituelles pour de nombreux aquariophiles.
Je pense pourtant qu'elles peuvent aider à mieux comprendre les transformations
successives de l'azote dans un aquarium.
Les composés azotés- L'azote organique Norg, est l'azote qui est lié au carbone pour former des molécules complexes. Dans les êtres vivants, l'azote organique se trouve principalement sous forme de protéines, d'acides nucléiques (ADN, ARN), dans certains polysaccharides comme la chitine (carapace des arthropodes) ou encore le peptidoglycane (paroi des bactéries). La teneur en azote des plantes peut être particulièrement basse, moins de 0.5% de leur masse totale alors que cette teneur peut atteindre 15 % chez les bactéries. Les êtres vivants se procurent l'azote dans leur environnement sous forme de substances chimiques dissoutes ou en consommant d'autres organismes. L'azote organique retourne dans l'environnement sous forme d'excrétion (urine, mucus) et sous forme de cadavres.
- En solution, l'ammonium NH4+ et l'ammoniaque NH3 sont en équilibre l'un avec l'autre
NH4+ <-> NH3 + H+
- La répartition entre les formes ammonium et ammoniaque dépend du pH. A des pH supérieurs à 9.2, la forme dominante est l'ammoniaque. Il peut être considéré comme absent à des pH inférieurs à 7.0. L'ammoniaque est extrêmement toxique, alors que l'ammonium ne l'est pratiquement pas. L'accumulation de l'ammonium cause de gros problèmes en aquariophilie marine (pH élevé), mais n'est pas vraiment problématique en eau douce (pH acide). On ne parlera plus ci-dessous que d'ammonium, en rassemblant les deux formes NH4+ et NH3.
- Les nitrites NO2- sont extrêmement toxiques et leur toxicité ne dépend pas du pH.
- Les nitrates NO3- sont moins toxiques que les nitrites. Certains poissons peuvent en supporter des concentration relativement élevées. Certains invertébrés les tolèrent mal.
- Les sels d'ammonium, de nitrite et de nitrate sont très solubles dans l'eau.
- L'atmosphère est constitué à 78% par l'azote moléculaire N2. Son nom qui signifie "sans vie" provient de sa faible réactivité chimique. Malgré sa grande disponibilité, peu d'organismes ont la capacité d'utiliser directement l'azote moléculaire comme source d'azote.
- On appelle azote combiné, l'azote sous toutes ses formes à l'exception de l'azote moléculaire N2.
Réactions biologiques impliquant les composés azotés
-
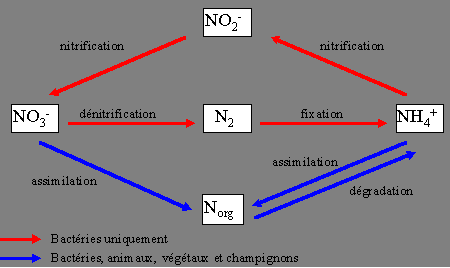
- L'assimilation de l'azote inorganique se fait par la consommation de l'ammonium ou du nitrate dissous dans le milieu. L'ammonium est la forme préférentiellement assimilée par les micro-organismes (bactéries et champignons), alors que le nitrate est la forme préférentiellement assimilée par les végétaux (plantes et algues supérieures). Les animaux tirent leur azote organique de la consommation d'autres organismes (animaux, végétaux ou bactéries).
- La dégradation de l'azote organique libère de l'ammonium. L'alimentation des animaux, et aussi celle de nombreux micro-organismes, est en général "trop riche" en azote et cet excédent d'azote est excrété sous forme d'ammonium (ou d'urée qui est rapidement dégradée en ammonium)
{Norg} ---> {Corg} + NH4+. - Ces réactions libèrent la partie carbonée des molécules Corg qui est ensuite décomposée en gaz carbonique et en "équivalent réducteur", que les microbiologistes notent par <H>
{Corg} ---> CO2 + <H>. - Un "équivalent réducteur" représente un électron accompagné d'un proton (ce qui correspond à un atome d'hydrogène) qui sont transportés par une molécule ad hoc. Les détails biochimiques ne nous intéressent pas et cette notation est bien pratique pour ça. Ces équivalents réducteurs sont destinés à être consommés par la respiration
4<H> + O2 ---> 2 H2O + énergie - qui permet aux cellules de se procurer l'énergie dont elles ont besoin.
- La nitrification est la conversion de l'ammonium en nitrate qui est réalisées par des bactéries spécialisées. Cette réaction se fait en deux étapes et on ne connaît pas de bactérie capable d'oxyder directement l'ammoniaque en nitrate. L'ammonium est oxydé en nitrite par les bactéries dites nitreuses
NH4+ + 2 H2O ---> NO2- + H+ + 4 <H> - et le nitrite est oxydé en nitrate par les bactéries dites nitriques
NO2- + H2O ---> NO3- + 2 <H>. - La nitrification ne peut se faire qu'en présence d'oxygène, qui est requis pour "brûler" les <H> et qui permet finalement aux bactéries de récupérer de l'énergie
4<H> + O2 ---> 2 H2O + énergie. - Il s'agit de la même équation décrivant la respiration que précédemment, mais l'origine des <H> est ici différente.
- La nitrification est un processus connu depuis fort longtemps en aquariophilie. La figure ci-dessous présente la (classique) succession des phases qui se déroulent lorsqu'un aquarium est démarré traditionnellement avec quelques moules ébouillantées, mais sans pierres ni sables vivants.
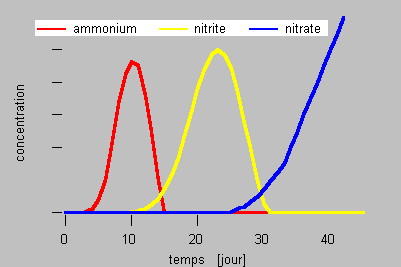
- L'azote organique des moules est rapidement dégradé en ammonium qui s'accumule dans l'eau. Les bactéries nitreuses ont alors à leur disposition tout ce dont elles ont besoin : de l'ammonium et de l'oxygène. Comme ces bactéries croissent lentement, il leur faut quelques jours pour arriver à consommer l'ammonium plus vite qu'il n'est libéré et ensuite le faire disparaître complètement. Simultanément, les nitrites s'accumulent, ce qui permet le démarrage de la croissance des bactéries nitriques. Il faudra plusieurs semaines pour que les populations de bactéries nitriques deviennent suffisamment importantes pour venir à bout des nitrites. Et finalement, les nitrates s'accumulent. Par la suite, tout l'azote organique dégradé est très rapidement converti en nitrate, évitant ainsi l'accumulation des composés intermédiaires toxiques, puisque maintenant des populations microbiennes suffisantes sont en place.
- Cette succession de stades est caractéristique du démarrage d'un aquarium dans lequel les bactéries nitrifiantes sont initialement présentes, mais en très petit nombre. L'apport de sable, ou du filtre, d'un aquarium déjà en service représente un apport massif de bactéries nitrifiantes et permet d'éviter ou d'en tout cas de raccourcir cette succession de phases. On peut ainsi réduire la phase de démarrage de plusieurs semaines à quelque jours... pour laisser son aquarium "se faire" pendant quelques semaines à un "stade" plus avancé. On trouve des préparations de bactéries nitrifiantes vivantes dans le commerce aquariophile. Elles me semblent fonctionner assez correctement et constituent une aide appréciable pour le démarrage des aquariums.
- L'introduction de pierres vivantes dans un aquarium neuf est souvent la cause d'une "montée de nitrites". Ces pierres vivantes sont pourtant censées apporter avec elles leur flore nitrifiante. En fait, suite à la mort de nombreux organismes durant le transport des pierres, la quantité d'azote organique relâché excède temporairement les capacités de cette flore. Ecumer, filtrer sur du charbon actif et pourquoi pas, filtrer temporairement sur un filtre à percolation bien "rôdé", doit permettre de minimiser la poussée de nitrites et de préserver ainsi les précieux organismes qui ont eu le mérite de survivre au transport.
- La dénitrification est la conversion des nitrates en azote moléculaire. Il s'agit en fait d'une respiration particulière, dans laquelle le nitrate est utilisé comme accepteur de <H> à la place de l'oxygène
10 <H> + 2 H+ + 2 NO3- ---> N2 + 6 H2O + énergie. - De très nombreuses bactéries sont capables de "respiration nitrate". Or, ces bactéries sont généralement aussi capables de "respiration oxygène" et elles s'abstiennent de respirer le nitrate dès que de l'oxygène devient disponible, parce qu'il est énergétiquement plus rentable de respirer sur l'oxygène que sur le nitrate. La dénitrification ne peut donc se produire donc qu'en absence d'oxygène ou anaérobiose.
- Dans les filtres dénitrateurs, on utilise différentes substances pour consommer l'oxygène en tête de filtre comme de l'éthanol, du bioplastique, etc. Le principe est de procurer suffisamment de <H> aux bactéries
{Corg} ---> CO2 + <H> (vu précédemment) - pour qu'elles puissent consommer tout l'oxygène
4<H> + O2 ---> 2 H2O + énergie (vu précédemment) - et qu'ensuite elles puissent s'attaquer aux nitrates
10 <H> + 2 H+ + 2 NO3- ---> N2 + 6 H2O + énergie. (vu ci-dessus) - Il existe un problème de "réglage" avec ce type de filtre. En effet, il peut subsister des <H> alors que l'oxygène et le nitrate sont épuisés. Un nouveau type de respiration devient alors possible, la respiration sur le sulfate SO42-
8<H> + SO42- ---> H2S + 2 H2O + 2 OH- - dont le produit est l'hydrogène sulfuré H2S, dont la toxicité est comparable à celle du cyanure. La présence d'hydrogène sulfuré se détecte facilement par l'apparition caractéristique de dépôt grisâtre ou noire de sulfure de fer (ou d'autre métaux). Par chance, ces sulfures
- métalliques sont extrêmement peu solubles ce qui limite la diffusion de l'hydrogène sulfuré. Les bactéries capables de respirations sulfates sont des anaérobes strictes. Elles ne supportent absolument pas la présence d'oxygène, ce qui restreint leur activité aux zones où l'anaérobiose est permanente. Pour être complet, mentionnons que la conversion de l'hydrogène sulfuré en sulfate en présence d'oxygène est le fait d'encore un autre groupe de bactéries, qui joue ainsi un rôle de détoxification... dans le compartiment de réoxygénation qui devrait toujours être placé après un dénitrateur.
- Pour compliquer encore un peu plus les choses, il faut mentionner l'existence d'un deuxième type de "respiration nitrate", dans laquelle le nitrate est convertit en nitrite ou en ammonium. Ce type de respiration est moins intéressant énergétiquement que la conversion en azote moléculaire. Il est pourtant utilisé comme "respiration de secours" par certaines bactéries lorsqu'elles sont soudainement placées en anaérobiosoe et en présence de suffisamment de nitrates. Les conséquences aquariophiles d'un tel type de respiration sont évidemment catastrophiques. Certains déboires rapportés jadis avec des filtres sous sables sont probablement liés a l'apparition brutale de ce deuxième type de respiration nitrate. Dans l'aquarium récifal où les nitrates se doivent d'être "non détectables", il n'a y pas grand chose à craindre.
- La fixation de l'azote est la conversion de l'azote atmosphérique en ammonium par des bactéries dites fixatrice d'azote. Cette réaction est le seul point d'entrée de l'azote atmosphérique dans la chaîne alimentaire
énergie + 8<H> + N2 + 2 H+ ---> 2 NH4+ + H2. - Comme la fixation de l'azote est très coûteuse en énergie (noter la synthèse d'une molécule d'hydrogène H2), les bactéries s'abstiennent de fixer l'azote si elles sont en présence d'une source d'azote combiné. La fixation de l'azote ne se déroule donc probablement jamais dans un aquarium peuplés de poissons seuls, l'inévitable présence de nitrate la rend sans intérêts pour les bactéries.
- L'oxygène constitue un poison violent pour le système enzymatique responsable de la fixation de l'azote, la nitrogénase. La plupart des bactéries fixatrices d'azote ne sont capable de le fixer que lorsque la concentration en oxygène est très faible, soit en anaérobiose, soit en "microaérophilie". Quelques bactéries ont cependant développé des moyens pour fixer l'azote dans un environnement où l'oxygène est présent en concentration "élevée". Par exemple, les cyanobactéries sont capables de fixer l'azote tout en produisant activement de l'oxygène par la photosynthèse. Le "truc" des cyanobactéries est de séparer les deux métabolismes, fixation de l'azote et photosynthèse, dans deux types de cellules distinctes. Les cellules qui fixent l'azote sont appelées hétérocystes et sont dotées d'une paroi plus épaisse qui contribue à isoler la nitrogénase de l'oxygène ambiant.
- Dans un aquarium récifal lorsque la concentration de l'azote dissout est faible, les cyanobactéries peuvent constituer une peste, la fixation d'azote leur donnant un avantage pour profiter des autres éléments accumulés dans l'eau,comme les phosphates.
- La fixation de l'azote a surtout été étudiée dans ses implications agricoles. Les légumineuses (pois, luzerne, etc) forment des symbioses appelées nodules avec des bactéries du genre Rhizobium. La fixation d'azote a été démontrée dans les rizières et dans les roselières, où elle se produit à la surface des racines. Ces dernières apportent un peu d'oxygène dans un sol totalement anaérobie, situation "microaérophilique" idéale pour fixer l'azote. On retrouve une situation comparable dans le sol des herbiers sous-marins. Enfin la fixation d'azote a été démontrée dans les récifs coralliens au niveau du algal turf (?traduction?). Il existe donc une fixation d'azote effective dans ou au voisinage des récifs coralliens, qui contribue à expliquer leur productivité. Plusieurs projets de recherches sont en cours sur ce sujet en Australie et aux USA.
- La table ci-dessous donne un résumé des principales réactions impliquant les composés azotés et leur relation avec l'oxygène
Processus Réactif et produit Relation avec l'oxygène assimilation NH4+ -> {Norg} NO3- -> {Norg} indifférente dégradation {Norg} -> NH4+ indifférente nitrification NH4+ -> NO2- NO2- -> NO3- présence d'oxygène absolument requise dénitrification NO3- -> N2 absence d'oxygène requise fixation N2 -> NH4+ peu ou pas d'oxygène, les cyanobactéries font exceptions -
- Le cycle
de l'azote dans l'aquarium
Cette section est plus spéculative que les deux précédentes. J'ai essayé de présenter ma perception actuelle du cycle de l'azote dans l'aquarium. Cette vision est certainement simpliste et forcément subjective. Sa seule prétention est de servir de base à la discussion. Alors, n'hésitez pas à la critiquer!
La figure ci-dessous représente la circulation de l'azote et du carbone dans un écosystème idéal où ces éléments seraient parfaitement recyclés.
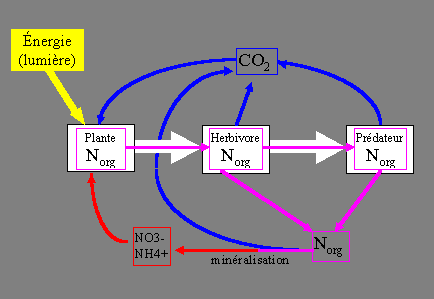
Les rectangles blancs représentent les populations végétales et animales et les flèches blanches les relations de consommation/prédation d'une population sur l'autre. L'azote organique peut ainsi "remonter" la chaîne alimentaire. Il passe des plantes aux herbivores, de ceux-ci aux prédateurs et finalement aboutit dans les détritivores (absents du schéma). Toutefois, à chaque étape, une fraction de l'azote organique est excrétée dans le milieu sous forme d'urine, de mucus, etc. Certains organismes comme par exemple les éponges sont capables de tirer profit de cet azote organique excrété (absent du schéma). L'azote organique dissous est minéralisé par les populations bactériennes, c'est-à-dire dégradé en ammonium puis oxydé en nitrates. Finalement ces nitrates sont assimilés par les végétaux et la boucle est bouclée. Pour que ce cycle puisse effectivement "tourner", il lui faut un apport énergétique extérieur qui provient de la lumière captée par les végétaux. La fixation d'azote et la dénitrification n'ont pas été pris en compte ici.
L'aquarium dédié au poissons. L'heureux possesseur de poissons d'aquarium tient par dessus tout à ses coûteux pensionnaires. Il évite l'instauration de relation prédateur/proie par le choix judicieux des organismes qu'il fait cohabiter. Pour les maintenir en vie, il est obligé de leur procurer de la nourriture, ce qui représente un apport d'azote organique exogène. Il s'en suit une production continuelle de déjections qui vont être minéralisées en nitrates par un filtre à percolation ad hoc. Comme la production végétale est le plus souvent négligeable dans ce type d'aquarium, les nitrates ne peuvent qu'inexorablement s'accumuler. Pour contrer cette accumulation, cinq techniques ont plus ou moins fait leur preuves (1) renouveler l'eau; (2) limiter l'apport de nourriture, c'est-à-dire limiter le peuplement de l'aquarium; (3) retirer l'azote organique avant sa minéralisation à l'aide d'un écumeur et dans une moindre mesure avec du charbon actif; (4) dénitrifier au moyen d'un filtre dénitrateur; (5) favoriser la croissance des algues, puis élaguer, afin de retirer de l'azote organique végétal (filtre à algues). Et il demeure toujours des nitrates dans l'eau de l'aquarium de poissons seuls.
La méthode berlinoise. Grossièrement résumé, il s'agit d'un aquarium qui comporte des pierres vivantes, un écumeur plutôt efficace, pas trop de poissons et une grande variété d'algues et d'invertébrés en partie venus avec les pierres. Cette recette en apparence simple permet de maintenir les nitrates à des concentrations non détectables, même en nourrissant copieusement les poissons. C'est un petit miracle. La figure ci-dessous présente une description de la circulation de l'azote dans cet aquarium Berlinois. Les flèches ont été épaissies ou amincies pour souligner les différences avec le cas idéal de la figure précédente. De plus ce système a été "ouvert", c'est-à-dire qu'il possède une entrée (input) qui est la nourriture des poissons, et deux sorties (outputs) que sont la dénitrification et l'écumage.
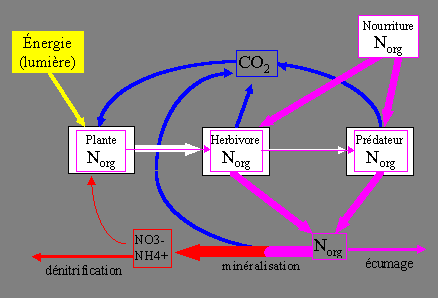
Le succès de la méthode berlinoise est généralement attribué à la dénitrification qui se produit dans les pierres vivantes. Celle-ci semble bien fonctionner à en croire l'absence d'accumulation de nitrates obtenue même dans des aquariums peu écumés. Il n'y a pas grand chose d'autre à ajouter sur la dénitrification, si ce n'est qu'à mes yeux un certain nombre de questions demeurent sans réponses satisfaisantes: quelle est l'importance de la zone anaérobie au sein des pierres vivantes? la dénitrification est-elle capable de consommer les nitrates jusqu'à une concentration "non détectable"? d'où viennent les <H> nécessaires à la dénitrification ? pourquoi les pierres ne produisent-elles pas de H2S ?
L'autre "sortie" d'azote de l'aquarium est l'écumeur. Or, de part son principe de fonctionnement, l'écumeur est incapable de retirer tout l'azote organique qui est présent dans un échantillon d'eau. Certaines substances s'accumulent préferentiellement dans l'écume parce qu'elles ont des propriétés tensio-actives. Les substances azotées qui ne s'accumulent pas dans l'écume vont inévitablement finir par être minéralisées. L'écumeur n'assure ainsi qu'une filtration partielle et c'est pourquoi il est incapable d'assurer à lui seul la filtration d'un bac de poissons seuls.
Sur les pierres existe toute une microflore d'algues et de bactéries qui consomme immédiatement le nitrate et/ou l'ammonium issus de la minéralisation. Cette microflore est continuellement "broutée" par la microfaune des pierres, ce qui stimule énormément sa croissance et donc sa capacité à consommer de l'ammonium et du nitrate. La microfaune comprend également des prédateurs qui se nourrissent des "brouteurs" et les poissons du bac jouent le rôle de superprédateurs pour tout ce petit monde. Il existe donc une chaîne alimentaire fonctionnelle dans l'aquarium berlinois, même si elle ne suffit en général pas à nourrir complètement les poissons. L'azote organique peut donc "remonter" la chaîne alimentaire et à chaque étape un peu d'azote organique se retrouve dissout dans l'eau (excrétion, urine, débris) dont une fraction est immédiatement retirée par l'écumeur.
En résumé, l'activité biologique apportées par les pierres vivantes permet de recycler continuellement l'azote jusqu'à ce qu'il se trouve sous une forme soit écumable soit "respirable". La biodiversité apportée par les pierres évite l'accumulation de l'azote sous quelles que formes intermédiaire que ce soit, si ce n'est en fin de compte sous la forme de poissons et de coraux.
La dénitrification et l'écumage retirent chacun une part de l'azote introduit avec la nourriture. Les proportions respectives de ces deux parts varient certainement beaucoup d'un aquarium à l'autre et dépendent du peuplement de l'aquarium, de la qualité (et quantité) des pierres vivantes et de l'efficacité de l'écumeur. De même, l'efficacité du recyclage de l'azote par la chaîne alimentaire doit passablement varier d'un aquarium à l'autre suivant le peuplement. Il est malheureusement techniquement difficile, mais pas impossible, de quantifier ces échanges. Je pense que si on avait accès à de tels chiffres, on pourrait mieux comparer les aquariums entre eux et comprendre pourquoi certains fonctionnent tellement mieux que d'autres. Enfin, il est évident qu'une analyse du fonctionnement d'un aquarium basée uniquement sur l'azote est incomplète. D'autres éléments chimiques sont à prendre en compte, à commencer par le carbone et le phosphate... mais il fallait bien commencer quelque part!
