Coraux
mous non-photosynthétiques
J. Charles DELBEEK
Au cours des 15 dernières années la capacité de recréer
un morceau de récif vivant à son domi-cile a atteint des sommets
sans précédent. Avec le développement de l'éclairage d'intensité
élevée, la maintenance de coraux exigeant de la lumière est devenue
possible car maintenant à la portée de presque chaque aquariophile.
Des coraux tels Acropora, Montipora et Seriatopora sont maintenant
couramment maintenus et reproduits dans des aquariums personnels.
Toutefois il subsiste un groupe de coraux qui, en dépit des progrès
réalisés au cours des quinze dernières années, ont pourtant prouvé
qu'ils sont presque impossibles à maintenir. Bien qu'il y ait quelques
cas isolés où quelques succès ont été rapportés, la maintenance
de ces coraux durant de longues périodes, au cours desquelles la
croissance et la multiplication ont approché des taux proches de
ceux de la nature, reste encore illusoire. Couramment connus comme
coraux sans zooxanthelles ou non-photosynthétiques, ils comprennent
différents genres et familles.
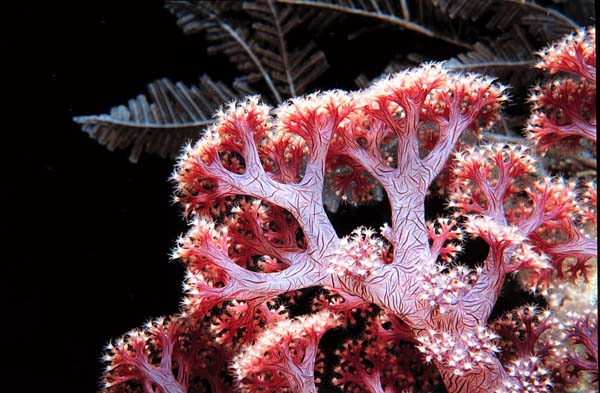 |
| Dendronephthya species |
Ceux-ci comportent des coraux mous comme Chironephthya,
Dendronephthya, Scleronephthya, Siphonogorgia et les gorgones comme
Acabaria, Acalcygorgia, Melithaea et Subergorgia, les coraux noirs
et les coraux fil de fer comme Anthipathes et Cirrhipathes, les
coraux filigranes (coraux hydroïdes) comme Stylaster et Distichopora
ainsi que bien sûr les coraux durs du genre Tubastrea.
Les raisons de ce faible succès avec la majorité de ces coraux peuvent
être reliées au fait que ces coraux nécessitent d'être nourris.
Il faut leur fournir suffisamment de nourriture d'espèces et tailles
adéquates. Jusqu'à présent, on ne savait presque rien concernant
les exigences alimen-taires de ces coraux. La plus grande partie
des coraux mous et des gorgones dépendent essen-tiellement des zooxanthelles
pour leur alimentation. Toutefois des études récentes ont montré
que les zooxanthelles ne sont pas capables de couvrir l'intégralité
des besoins nutri-tionnels de tous les coraux mous. Fabricius et
Klumpp (1995) ont découvert que douze des espèces de coraux mous
photosynthétiques courants étudiés vivant dans la Grande Barrière
de Corail ne pouvaient pas couvrir leurs besoins en carbone par
la seule photosynthèse. Ceci soulève la question de savoir d'où
justement ils obtiennent leur carbone? De nombreux octocoralliaires
sont connus comme mangeurs polytrophiques ceci signifiant qu'ils
sont capables d'obtenir la nutrition de plus d'une source (Williams,
1993). Les sources possibles peuvent être l'une ou toutes celles
qui suivent: l'absorption directe de nutriments, l'ingestion de
zooplancton et/ou de phytoplancton ou l'ingestion de "neige marine
" avec ses matières bactériennes et organiques qui l'accompa-gnent.
Plusieurs études ont montré que les coraux mous, les gorgones et
les plumes de mer (Pennatulacés) peuvent se nourrir de divers zooplanctons
comme des œufs et des nauplies de copépodes, d'autres œufs d'invertébrés
et d'autres petits animalcules de faible mobilité. Nombre de ces
études, toutefois, ont été menées en laboratoire, utilisant des
nourritures artificielles (Artemia) ou des concentrés de zooplancton
naturel de densité inconnue (Fabricius et al.,1995b).
Ces études ont montré que les octocoralliaires sont hautement sélectifs
en ce qui concerne les formes non fuyantes comme les larves de mollusques,
témoignant d'une faible capacité de capture de proies plus mobiles
comme de grands copépodes adultes. Cette faible capacité de capture
est très probablement due à un manque de nématocystes efficaces,
ayant pour résultat une sélection de proies moins mobiles (Fabricius
et al., 1995 b). En fait, Fabricius (donnée non publiée) a trouvé
que l'incapacité de manger du zooplancton était répandue chez les
genres de coraux mous avec zooxanthelles de la Grande Barrière Récifale
(c. à d. : Sarcophyton 3 spp., Sinularia 2 spp., Cladellia sp.,
Nephthea sp. et Paralemnalia sp.). Jusqu'à présent, le rôle que
joue le phytoplancton dans la nutrition des octocoralliaires photosynthétiques
n'est pas très clair mais de nouvelles informations montrent qu'il
contribue seulement à une petite partie du budget nutritionnel de
nombreux octocoralliaires (Fabricius et al., 1995 a et b). Quoi
qu'il en soit, un certain nombre des études qui se sont intéressées
à la capacité des coraux de manger du zoo-plancton utilisaient souvent
des nauplies d'Artémia comme proies dans des situations contrô-
lées. Les Artemia sont plutôt grandes et il n'est pas surprenant
étant donné les petits néma-tocystes inefficaces de nombreux coraux
mous qu'elles ne soient pas capturées facilement. Peut-être que
du zooplancton plus petit comme des nauplies de copépodes, des rotifères
ou des infusoires marins sont absorbés. Toutefois, la question subsiste,
si ce n'est pas le zooplancton quelles sont leurs proies principales?
Le phytoplancton constitue un ordre de grandeur plus courant dans
les récifs coralliens que le zooplancton. Des études ont montré
que le phytoplancton est d'une façon ou d'une autre épuisé dans
les récifs coralliens, bien que personne ne sache où il va (dans
Fabricius et al., 1995 b). En 1961 Roushdy et Hansen ont démontré
que le corail mou asymbiotique Alcyonum digitatum se nourrissait
avec du phytoplancton daté au carbone 14 (dans Fabricius et al.,
1995 a). En 1969 il a été démontré que le Pennatulacé Ptilosarcus
gurneyi provenant des eaux tempérées se nourrit essentiellement
de phytoplancton; son éclatante couleur orange, le résultat de caroténoïdes
provenait d'un régime à base de dinoflagellés (dans Best, 1988).
Elyakova et al. (1961) ont trouvé au cours d'une étude générale
des carbohydrases chez les invertébrés marins la présence de laminarase
et d'amylase chez trois espèces de coraux mous avec zooxanthelles
du genre Alcyonium. Ces substances chimiques sont des enzymes impliquées
dans la digestion de matière végétale. Ce n'est qu'après 1995 que
Fabricius et al. (1995 a et b) ont publié des docu- ments qui ont
très clairement montré que les coraux mous sans zooxanthelles Dendronephthya
hemprichi de la Mer Rouge se nourrissaient largement de phytoplancton,
bénéficiant plus que suffisamment de carbone pour couvrir les besoins
de la respiration et de la croissance (Fabricius et al., 1995 b).
Bien que ces espèces se nourrissent aussi de zooplancton, seuls
2,4 à 3,5% des besoins journaliers de carbone de ce corail étaient
satisfaits par l'ingestion de zooplancton. Trois autres octocoralliaires
non symbiotiques, D. sinaiensis, Scleronephthya corymbosa et la
gorgo- ne Acabaria contiennent également des quantités importantes
de phytoplancton dans leurs cavités gastroventriculaires (Fabricius
et al., 1995 a). Les adaptations pour la capture du phytoplancton
comprennent de petits espaces entre les pinnules de Dendronephthya
hemprichi qui semblent idéaux pour filtrer le phytoplancton du courant.
Les grands spicules trouvés dans le tronc du corps et autour des
polypes de Dendronephthya spp., semblent avoir davantage un rôle
de maintien du corps et des polypes dressés dans le puissant courant
plutôt que de protection contre la prédation leur permettant de
filtrer avec efficacité le phytoplancton présent dans le courant
qui passe (Fabricius et al., 1995 b). Certaines des croissances
les plus impressionnantes de Dendronephthya spp. sont le plus souvent
trouvées sur les épaves de bateaux du Pacifique sud où les structures
sont souvent fortement ancrées au-dessus du fond se projetant dans
le courant! Il est tentant de les assimiler avec les fermes à huîtres,
où les huîtres sont pendues dans des cages bien au-dessus du fond
et au sein des courants puissants. Les deux organismes se nourrissent
de phytoplancton et en conséquence bénéficient de ces positions
en étant exposés à des concentrations maximales de phytoplancton.
A la lumière de ces nouveaux témoignages, les scientifiques ont
besoin de réévaluer le rôle du phytoplancton dans la nutrition des
autres octocoralliaires. Plusieurs études sont maintenant en cours
afin de déterminer jusqu'à quel point à la fois les possesseurs
de zooxanthelles et ceux qui en sont dépourvus se nourrissent effectivement
de zooplancton.
Une autre façon de se nourrir peut être la capture de flocons de
mucus souvent appelés " neige marine ". Ceux-ci sont composés de
déchets, de bactéries, de protozoaires et probablement de phytoplancton
piégés dans le mucus. La source de ce mucus peut être celle émise
d'une manière régulière par les coraux mous et durs pour se débarrasser
des parasites ainsi que des excès de carbone et de graisses. Ce
mucus n'est pas facilement décomposé par les bactéries et est souvent
infesté par de grandes quantités de bactéries et d'eukaryotes (flagellés,
ciliés et diatomées) (Vacelet et Thomassin, 1991). Ces flocons de
mucus pourraient être piégés par les polypes pointus des Dendronephthya
spp. et utilisés comme source de nourriture. Pour autant que je
sache, personne n'a procédé à des investigations concernant le rôle
possible de ces matières dans la nutrition des octocoralliaires.
Il est très probable que les octocoralliaires se servent d'une combinaison
de certains ou de tous les mécanismes d'alimentation décrits, avec
une importance variable pour chacun.
Muni des informations ci-dessus, présentées la première fois aux
amateurs dans l'Aquarium Récifal Volume 2, (Sprung et Delbeek, 1997)
plusieurs sociétés fournissant les aquariums ont maintenant mis
à disposition différents mélanges de phytoplancton certains vivants
d'autres cryogénisés, ou représentés
par des cellules d'algues mortes. La plupart de ces produits ont
au départ été développés pour l'aquaculture. Bien que le phytoplancton
semble être important pour les coraux mous son rôle pour d'autres
coraux non-photosynthétiques n'est pas prouvé et peut en effet être
discutable. Certainement que des coraux comme Tubastrea spp. et
les anthipataires sont connus pour prendre comme proie du phytoplancton.
Les besoins de certaines gorgones peuvent aussi être satisfaits
en utilisant du zooplancton.
Comme
il en ressort, les aliments nécessités pour le succès constituent
seulement une pièce du puzzle. Un autre facteur d'importance identique
est le mouvement de l'eau; non seulement le type mais aussi la vitesse
de l'eau peut être critique pour certains genres, mais moins critique
pour les autres.
Etant donné que les polypes des octocoralliaires possèdent peu ou
pas de petites cellules urticantes (ou aucune du tout) et que leurs
pinnules présentent une grande surface, ils sont généralement classés
comme mangeurs de substances en suspension filtrant de fines particules
dans l'eau qui passe. En tant que tel leur efficacité d'alimentation
est affectée par la vitesse du courant, la souplesse des polypes
et de la colonie ainsi que leur orientation. Plusieurs études ont
montré que l'efficacité de l'alimentation augmente jusqu'à une vitesse
maximale puis tombe avec des vitesses au delà de cela (Best, 1988
; Sponaugle et LaBarbera, 1991 ; Dai et Lin, 1993 ; Fabricius et
al., 1995 b).
Toutefois, la flexion des polypes et de la colonie peuvent agir
ensemble afin d'augmenter le champs des vitesses du courant au delà
desquelles l'alimentation à partir de substances en suspension est
couronné de succès (Sponaugle, 1991). Les polypes eux-mêmes peuvent
effectivement moduler le courant autour d'eux afin d'accroître la
capture de proies.
Dans une étude sur les effets du courant sur la capture des particules
chez l' octocoralliaire asymbiotique Alcyonium siderium, Patterson
(1991) a trouvé que par courant faible (2,7 crn/s) les tentacules
dirigés sur le côté à contre-courant des polypes capturent la plupart
des proies. En présence d'un courant intermédiaire (12,2 cm/s) les
tentacules situés à l'aval parmi les polypes capturent la plupart
des proies.
Dans des courants puissants (19,8 cm/s) les polypes
sont fléchis en aval, des tourbillons se forment au-dessus de la
surface des polypes et tous les tentacules capturent effecti-vement
des proies. Les proies sont capturées avec le plus d'efficacité
aux extrémités des tentacules relatifs aux endroits proches de la
bouche (Patterson, 1991). Aucun courant n'est le meilleur pour toutes
les espèces. Par exemple, Dai et Lin (1993) ont trouvé trois gorgones
asymbiotiques taiwa-naises Subergorgia suberosa, Acantho-gorgia
vegae et Melithaea ochracea s'alimentant dans une fourchette importante
de courants.
 |
| Crédit photo : J.C. Delbeek |
La capacité de maintenir les polypes ouverts est aussi
en relation avec les débits du courant et la taille de leurs polypes.
Subergorgia suberosa possède les polypes les plus grands, qui étaient
déformés par les vitesses les plus faibles du courant (> 10 cm/s),
gênant beaucoup la capture des proies. Par contraste, Melithaea
ochracea, qui possède les polypes les plus courts et les moins facilement
détonnés sous des débits de courant élevés, pourrait se nourrir
aux débits les plus élevés (40 cm/s). Les polypes d'Acanthogorgia
vegae ont une taille de polypes inter-médiaires et se nourrissent
dans des courants de 0 à 24 cm/s. Bien que tous les trois s'alimen-
tent effectivement dans des courants de 8 cm/s, S. suberosa possédait
le champs d'alimentation le plus limité (5 à 10 cm/s) tandis que
M. ochracea possède le plus large (4 à 40 cm/s) (Dai et Lin, 1993).
Cette capacité variable de s'alimenter dans divers courants est
un facteur majeur déterminant la distribution dans les récifs. Dans
les récifs taiwanais australs Melithaea ochracea représente la gorgone
la plus répandue, implantée sur la zone supérieure de front récifal,
là où les courants sont plus puissants. Subergorgia suberosa, qui
se nourrit dans une zone limitée de vitesses de courant, a une repartition
restreinte, se situant sur les pentes récifales basses ou sur les
blocs de pierre abrités où les courants sont plus faibleso Acanthogorgia
vegae qui peut s'alimenter dans des courants relativement puissants
se trouve plus couramment dans les fronts récifaux semi-exposés
ou sur les côtés latéraux des blocs de pierre (Dai et Lin, 1993).
Par conséquent le courant et ses interactions avec les polypes et
les colonies semblent avoir une influence énorme sur les schémas
de répartition des colonies, la croissance de la colonie, la taille
et la morphologie ainsi que le rythme des échanges gazeux. (dans
Fabricius et al., 1995 b).
 |
| Dendronephthya species |
Pour résumer, dans des courants croissants, les fréquences
d'alimentation augmentent au début, atteignent l'apogée puis diminuent
comme le courant augmente. Etant trop impor-tant, un courant peut
aussi obliger les polypes à rester ouverts durant des périodes de
plus en plus courtes et en ayant des débits trop faibles cela ne
stimule pas les polypes à s'ouvrir et à s'ali-menter.
Dans les aquariums les deux types de mouvements d'eau prédominants
sont laminaires et chaotiques. Les courants laminaires appa-raissent
près des sorties de pompes et des retours de l'eau. Les courants
chaotiques commencent à apparaître plus loin de ces sources étant
donné que l'eau qui s'écoule rencontre la résistance de l'eau, des
parois du bac, des roches et des coraux. Néanmoins ces zones, où
dans le récif apparaissent la majorité des coraux non-photosynthétiques
(le long des tombants et des passages dans les récifs), ont des
courants laminaires qui d'habitude se pro-duisent dans les cycles
des marées.
Le débit d'eau va graduellement augmenter vers une direction, puis
change de sens et augmente de nouveau. Il existe des périodes de
marées "molles" entre ces deux extrêmes. Les coraux de ces zones
reçoivent donc un puissant courant laminaire dans une direction
durant plusieurs heures suivi d'une période peu active, puis une
autre période de courant puissant dans la direction opposée durant
plusieurs heures. Recréer cela en aquarium est difficile et peut
nécessiter la conception d'un nouveau bac et des dispositifs pour
le mouvement de l'eau.
 Au Waikiki Aquarium nous avons travaillé avec un bac
cylindrique pour créer ces conditions en utilisant deux pompes fonctionnant
sur des minuteries. Le bac alimenté par un courant continu d'eau
de mer naturelle contient du sable vivant, quelques pierres vivantes,
ainsi il n'y a pas besoin d'une autre filtration. L'éclairage est
fourni par la lumière solaire ambiante provenant de panneaux aériens
acryliques avec un peu de soleil direct durant quelques heures chaque
jour. D'autres conceptions de bacs peuvent aussi être utilisées.
Au Waikiki Aquarium nous avons travaillé avec un bac
cylindrique pour créer ces conditions en utilisant deux pompes fonctionnant
sur des minuteries. Le bac alimenté par un courant continu d'eau
de mer naturelle contient du sable vivant, quelques pierres vivantes,
ainsi il n'y a pas besoin d'une autre filtration. L'éclairage est
fourni par la lumière solaire ambiante provenant de panneaux aériens
acryliques avec un peu de soleil direct durant quelques heures chaque
jour. D'autres conceptions de bacs peuvent aussi être utilisées.
Par exemple à l'Aquarium de Vancouver au Canada, on a réalisé une
exposition de gorgones d'eau froide qui utilise un bac à courant
équipé de pompes très puissantes pour recréer les puissants courants
des marées qui se produisent dans certains passages entre les îles
situées au large de la Colombie Britannique !
 Tubastrea species |
Au Waikiki Aquarium nous avons eu quelques succès
modérés dans la maintenance de certaines espèces de coraux noirs
et de bons succès avec les coraux fil de fer en les alimentant avec
un régime d'Artemia et de copépodes enrichis.L'Aquarium de Long
Beach, Californie, a obtenu quelques succès avec Dendronephthya,
Distichopora et quelques autres coraux mous en utilisant un régime
de phytoplancton comprenant Chlorelle sp., Spirulina sp., Isochrysis
sp. et Nanochloropsis sp. A cela ils ont ajouté des rotifères et
des Artemia enrichis. Ils ont aussi remarqué que Dichlopora, contrairement
aux coraux mous non photosynthétiques, nécessitent sans aucun doute
de faibles niveaux d'éclairage. S'ils sont placés sous un éclairage
même modéré, des organismes gênants adhèrent à leurs tissus délicats
et cela se termine par la mort. Le Shedd Aquarium de Chicago, a
tenu une colonie de Dendronephthya durant plus d'une année, laquelle
a eu une croissance visible. Ils se nourrissent de phytoplancton
aussi bien que de rotifères et de copépodes vivants. Notre succès
avec les Dendronephthya est moins concluant. Au début de décembre
2000 nous avons récolté quinze petites colonies de Dendronephthya
aux Fidji et les avons transportées à Hawaii sous autorisation.
A présent (17 mars 2001) sept des quinze colonies survivent encore
depuis leur récolte il y a trois mois aux Fidji. Bien que nous ayons
essayé plusieurs types de nourriture comme du phytoplancton marin
(Chaetoceros, Isochrysis, Nanochloropsis, etc.), copépodes, rotifères,
suppléments d'acides gras, produits de "neige marine" nous
avons eu des résultats mitigés. Dans certains cas des colonies endommagées,
ont lentement diminué de taille. Suffisamment intéressante pour
être citée, la réaction la plus importante aux substances ajoutées
à l'aquarium s'est produite de deux façons. Lorsque la vitre intérieure
était débarrassée des algues les colonies montrent un accroissement
de taille après une heure ou plus tard. Deuxièmement, lorsque le
jus de calamars surgelés décongelés est ajouté à l'aquarium, les
colonies montrent l'augmentation la plus importante en développement.
Il est possible que ces coraux se nourrissent en plus grande quantité
de zooplancton que les recherches ne l'ont indiqué et les aquariophiles
ne devraient pas seulement compter sur le phytoplancton comme source
de nourriture. Peter Wilkens a été capable de maintenir de petites
colonies durant quelque temps dans son aquarium en remuant occasionnellement
le substrat, libérant des déchets et très certainement des bactéries
et autre endofaune, dont les coraux semblent aussi se nourrir.
L'orientation des colonies est un autre facteur qui peut jouer un
rôle significatif. Les colonies qui ont été placées verticalement
dans le sol sablonneux de notre système ont semblé se porter correctement
au début, mais le temps passant, ont commencé à rétrécir en taille.
En les plaçant à l'envers sur une structure les supportant, ces
colonies ont lentement repris et ont eu un meilleur aspect, certaines
montrant même une nouvelle croissance et une nouvelle fixation au
substrat. La clé semble être d'empêcher les colonies de toucher
le sol avec leurs branches, ceci semble les irriter et il en résulte
une perte des spicules. Ceci est d'une très grande importance lorsque
la colonie est dégonflée. Une autre observation intéressante est
que le gonflement et le dégonflement ne semblent pas suivre de schéma
perceptible. Tôt le matin les colonies sont dégonflées puis se regonflent
plus tard dans la matinée et restent ainsi durant la plus grande
partie de la journée, bien que le dégonflement puisse aussi se produire
à n'importe quel moment de la journée.
 Scleronephthya |
Plusieurs questions restent sans réponse en ce qui concerne la maintenance de coraux non-photosynthétiques. Le rôle de la température, l'orientation de la colonie, la composition nutritionnelle de la nourriture et les meilleures techniques de récolte des coraux, la manipulation et le transport en constituent quelques-unes qui nécessitent d'être étudiées au cours des prochaines années. Nous commençons à voir des succès limités avec nombre des coraux non-photosynthétiques qui étaient très difficiles à maintenir et ce n'est qu'une question de temps jusqu'à ce que des bacs remplis de coraux non-photosynthétiques colorés, des organismes non-photosynthétiques en bonne santé soient aussi courants que le sont de nos jours des bacs remplis de Sarcophyton.
Charles Delbeeck est né à Toronto en 1958. Il s'est pour la première fois équipé d'un masque à l'age de 5 ans, pour passer au scaphandre autonome à 14 ans. C'est à cette époque qu'il a commencé à maintenir des organismes marins. Son amour de la mer l'a mené à de nombreuses expéditions sous les tropiques, mais aussi à l'Université de Toronto où il a obtenu une licence de biologie, un magistère de zoologie et une licence de sciences de l'éducation. Charles a su conjuguer ses connaissances fondamentales avec son expérience et ses compétences en aquariophilie pour écrire de nombreux articles dans les publications scientifiques comme Canadian journal of Zoology, Environmental Biology of Fishes, Journal of Animal Ecology, Journal of Fisch Biology et des revues telles Aquarium Fish Magazine, Aquarium Frontiers, Atoll, Freshwater and Marine Aquarium, Het Zee-Aquarium et SeaScope. Il est coauteur de la série "l'Aquarium Récifal" avec Julian Sprung. |
BIBLIOGRAPHIE
Best, B.A. 1988. Passive suspension feeding
in a sea pen: effects of ambient flow on volume flow rate and filtering
efficiency. Biol. Bull. 175:332-342.
Dai, C.D. and M.C. Lin. 1993. The effects of flow on feeding of
three gorgonians from southern Taiwan. J. Exp. Mar: Biol. Ecol. 173:57-69.
Elyakova, L.A., Shevchenko, N.M. and S.M. Avaeva. 1981. A comparative
study of carbohydrase activities in marine invertebrates. Comp.
Biochem. Physiol. 69b:905-908. Fabricius, K.E. and D. W Klumpp.
1995. Wide-spread mixotrophy in reef-inhabiting soft corals: The
influence of depth and colony expansion and contraction on photosynthesis. Mar: Ecol. Progr. Ser. 126:145-152.
Fabricius. K.E., Benayahu, Y. and A. Genin. 1995a. Herbivory in
asymbiotic soft corals. Science 268:90-92.
Fabricius, K.E., Genin,A. and Y. Benayahu. 1995b. Flow-dependant
herbivory and growth in zooxanthellae-free soft corals. Limnol.
Oceanogr. 40:1290-1301.
Patterson, M.R. 1991. The effects of low on polyp-level prey capture
in an octocoral, Alcyonium siderium. Biol. Bull. 180:93-102.
Sponaugle, S. 1991. Flow patterns and velocities around a suspension-feeding
gorgonian polyp: Evidence for physical models. J. Exp. Mar. Biol. Ecol. 148:135-145.
Sponaugle, S. and M. LaBarbera. 1991. Drag-induced deformation:
a functional feeding strategy in two species of gorgonians. J.
Exp. Mar. Biol. Ecol. 148:121-134.
Sprung, J. and J.C. Delbeek. 1997. The Reef Aquarium: A Comprehensive
Guide to the Identification and Care of Tropical Marine Invertebrates. Ricordea Publ., Coconut Grove, FL, USA, 546 pp.
Vacelet, E. and B.A. Thomassin. 1991. Microbial utilization of coral
mucus in long-term in situ incubation over a coral reef. Hydrobiologia 211: 19-32.
Williams, G.C. 1993. Coral Reef Octocorals: An lllustrated Guide
to the Soft Corals, Sea Fans and Sea Pens Inhabiting the Coral Reefs
of Northern Natal. Durban Natural Science Museum, Durban, South
Africa. 64 pp
© Récif France avril 2001- Les textes et photos restent la
propriété des auteurs.






