





Reproduction
de scléractiniaires en captivité :
perspectives actuelles et futures
Dirk Petersen
L'?levage de scl?ractiniaires en captivit? constitue l'un des succ?s
le plus impressionnant ? l'actif des aquariophiles marins actuels. La maintenance
de coraux durs dans un aquarium donne la possibilit? de cr?er un habitat
r?cifal presque naturel avec toute sa fascination en diversit? d'esp?ces
et d'interaction ?cologique. Les aquariums actuels montrent une magnifique
diversit? animale et v?g?tale que personne n'a os? esp?rer il y a vingt
ans. Un aquarium repr?sente l'outil id?al pour ?tudier la vie marine, pour
?duquer les gens, simplement pour ?tre fascin? par la beaut? de la nature
et dernier point et pas le moindre ? reproduire des esp?ces en danger.
Les scl?ractiniaires constituent les esp?ces cl?s dans la plupart des divers
?cosyst?mes marins mondiaux : le r?cif corallien. Les r?cifs actuels sont
menac?s par diverses r?percussions naturelles et anthropog?niques. Les
perturbations ont dramatiquement augment? au cours de ces derni?res ann?es
et atteint un niveau record en ce qui constitue la plus importante mortalit?
massive de nombreuses esp?ces de coraux jamais observ?e. Outre le r?chauffement
global et El Ni?io, d'autres effets essentiellement anthropog?niques jouent
un r?le important. C'est l? qu'il faut citer la s?dimentation et l'importation
de nutriments (d?forestation des for?ts tropicales humides, l'agriculture,
la croissance des populations c?ti?res), la surp?che ou l'augmentation
du stress d? au tourisme. Ces facteurs affectent ?norm?ment la reproduction
des coraux scl?ractiniaires hermatypiques.
Les aquariophiles marins peuvent jouer un r?le important dans la protection
des r?cifs actuels. Quoiqu'il ait ?t? estim? que le commerce des coraux
vivants joue un r?le mineur dans la d?gradation des r?cifs (Green & Frances,
1999), il est important pour l'avenir de ce hobby de diminuer la r?colte
dans la nature, ainsi des m?thodes de reproduction doivent ?tre cr??es.
Au cours de cette pr?sentation, je vais esquisser les efforts actuels et
les perspectives futures de reproduction des coraux durs en captivit?. Je
vais surtout d?battre d'une m?thode de recrutement des planulae (larves
cili?es) dans un syst?me clos que j'ai d?velopp? pendant mes ?tudes de
biologie.
Reproduction des coraux ou l'importance du sexe
 |
|
1)
Planula d'un incubateur (Pocillopora Damicornis
Les points noirs indiquent des zooxanthelle. (40x) |
Les coraux ont d?velopp? un nombre ?norme de strat?gies de reproduction
(Harrison & Wallace, 1990). Diff?rents m?canismes asexu?s comme la fragmentation,
les polypes-fils, la scissiparit? ou les colonies satellites m?nent ? de
nouvelles colonies qui sont g?n?tiquement identiques. En ce qui concerne
la reproduction sexu?e, les coraux investissent des r?serves ?nerg?tiques
?lev?es pour produire soit des millions de spermatozo?des et d'?ufs qui
sont rel?ch?s en pleine eau pour la f?condation externe (pon- deurs en
pleine eau) soit des milliers de planulae susceptibles de se fixer qui sont
lib?r?s par le polype m?re (incubateurs). Etant donn? le taux de survie
extr?mement faible des ?l?ments reproducteurs, les esp?ces pondeuses en
pleine eau peuvent produire de 240 ? 2880 ?ufs par cm2 par an,
les esp?ces incubatrices de 48 ? 528 ?ufs par cm2 par an (calcul?
d'apr?s Szamt, 1986). Le taux de mortalit? des coraux juv?niles durant
les premiers 3 ? 12 mois de leur vie se situe entre 60 ? 80% (Sorokin, 1995).
Concernant ces circonstances une question doit ?tre pos?e: serait-il plus
efficace de diminuer la d?pense ?nerg?tique pour la reproduction sexu?e
envers celle asexu?e ? En d'autres termes - pour quelle raison les coraux
utilisent-ils plus d'?nergie pour le d?veloppement des planulae sexu?es
s'ils peuvent produire plus de propagules asexu?s ayant un taux de survie
beaucoup plus ?lev? ?
 |
 |
| 2)
Planula d'Acropora florida sans aucune pigmentation. Les zooxanthelles des esp?ces de ponte en pleine eau sont habituellement incorpor?es apr?s la fixation. (40x) |
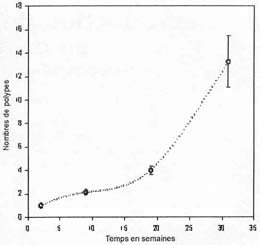
Figure 1. Croissance d'Acroporaflorida apr?s fixation, mesur? en nombre de polypes par colonie (petersen & Tollrian ? l'impression). |
En g?n?ral, la reproduction sexu?e sert ? la recombinaison des g?nes
pour une diversit? g?n?tique plus importante de la population. Pour les
esp?ces il est essentiel de r?agir aux conditions environnementales changeantes.
Il faut surtout mentionner ici la bataille ?volutive entre coraux et parasites
sp?cifiques. Chez Acropora spp. l'importance de la reproduction sexu?e peut
?tre sp?cifique aux esp?ces. Certaines esp?ces qui se reproduisent rarement
par fragmentation peuvent produire des quantit?s de gam?tes sensiblement
plus importantes (Wallace, 1985). De plus chez de nombreux genres ayant typiquement
de larges polypes la seule possibilit? de reproduction efficace est la planulation.
Consid?rant les facteurs mentionn?s auparavant, il serait important d'int?grer
la reproduction sexu?e dans les efforts de reproduction en captivit?. Sinon
l'avenir des populations en captivit? et m?me nombre r?cifs coralliens
r?habilit?s pourront ressembler ? une monoculture d'esp?ces limit?es
en nombre de faible diversit? g?n?tique.
|
Espèces
|
Mécanismes
de reproduction*)
|
Citations
|
| Acropora
spp. Agaracia sp. Dichocoenia stockesi Euphyllia grabescens Favia fragnum Fungia sp. Porites attenuata Porites asteroides Porites porites Porites sp. Pocillopora sp. Pocillopora damicornis Pocillopora verrucosa Stylophora pistillata Tubastrea coccinea |
Incubateur
2,3,4, Pondeur en pleine eau 1,2,4 Incubateur 3,4 ? Incubateur 4 Incubateur 3,4 Incubateur 2, Pondeur en pleine eau 2.4 ? Incubateur 4 Incubateur 4 Incubateur 4, Pondeur en pleine eau 4 Incubateur2,4 , Pondeur en pleine eau 1 Incubateur 2,3,4 Incubateur 3,4 Pondeur en pleine eau 1 Incubateur 1,2,4 Incubateur 2 |
Adey
& Loveland (1998) Adey & Loveland (1998) Adey & Loveland (1998) Adey & Loveland (1998) Adey & Loveland (1998) St?ber(1994) Adey & Loveland (1998) Adey & Loveland (1998) Adey & Loveland (1998) Brockmann (1994) Adey & Loveland (1998) Adey & Loveland (1998) Tyree (1995) Fossa & Nilsen (1998) Adey & Loveland (1998) |
| Tableau
1. Reproduction sexu?e en captivit? couronn?e de succ?s de scl?ractinaires
(d'apr?s Petersen 1999b). *) M?canismes de reproduction d'apr?s 1 = Shlesinger et al. (1998),2 = Sorokin (1995), 3 = Harrison & Wallace (1990),4 = Fadlallah (1983). |
||
Qu'est-ce qui est actuellement faisable?
Actuellement plus de 150 esp?ces de coraux scl?ractiniaires peuvent ?tre
reproduites par mode asexu? en aquarium (Bomeman & Lowrie, 1999). De cette
mani?re des clones de la colonie originelle peuvent ?tre produits en quantit?s
relativement importantes. En g?n?ral, les fragments montrent des taux de
croissance plus importants que les colonies adultes, ainsi de nouvelles colonies
peuvent ?tre produites en une courte p?riode de temps. Diverses esp?ces
de scl?ractiniaires ont d?j? ?t? reproduites ex situ en mode sexu?.
Le tableau 1 souligne mon hypoth?se selon laquelle tous les r?sultats observ?s
de reproduction sexu?e en captivit? semblent appartenir aux colonies de
coraux incubateurs. Les planulae lib?r?es par les incubateurs sont capables
de se fixer ? la fois avant d'?tre pris par les syst?mes de filtration
ou d'?tre d?truites par les pales des pompes. Les larves des esp?ces pondant
en pleine eau n?cessitent normalement quelques jours avant d'?tre capables
de se fixer. Dans un bac communautaire r?cifal le volume complet d'eau traverse
d'habitude le syst?me de filtration une ? deux fois par heure, ainsi il
est peu probable qu'une planula se d?veloppant puisse survivre jusqu'? ce
qu'elle atteigne sa capacit? de fixation. Aussi Nilsen (1998) a rapport?
une ponte massive dans un bac r?cifal qui ne pr?sentait aucun colon juv?nile.
R?cemment Fan et al. (2000) ont travaill? avec succ?s sur la planulation
et la fixation de diverses esp?ces incubatrices dans des syst?mes ouverts
approvisionn?s en eau de mer naturelle.
J'ai d?montr? la possibilit? d'?tablir et de recruter des planulae d'esp?ces
pondant en pleine eau (Acropora florida) dans un aquarium en syst?me
clos ? Munich, Allemagne (Petersen, 1999a, Petersen & Tollrian ? l'impression).
Etablissement et recrutement d'Acropora florida dans un aquarium
en syst?me clos
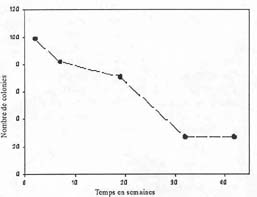 |
| Figure 2. mortalité post-fixation de colnies d'Acropora florida sur des tuiles en céramique. |
L'aquarium en syst?me clos a ?t? install? 9 mois avant le d?but de l'exp?rimentation.
Un bac principal et plusieurs bacs de traitement (volume d'eau global : 1200
litres d'eau de mer synth?tique) ont ?t? reli?s les uns aux autres. La
filtration est g?r?e par l' ?cumage (d?bit de passage: 400 l/h) et des
pierres vivantes provenant d'Indon?sie. Quelques mois auparavant quelques
scl?ractiniaires ont ?t? introduits (y compris plusieurs fragments d' Acroporid?s).
Les param?tres chimiques de l'eau indiquent une excellente qualit? d'eau
(salinit?: 38%0, Ca2+: 11 Mmol/l ; CO32-
8-10 dKH (duret? carbonat?e en ° allemand) ; PH: 8,1-8,27 ; NO3
: <0.08 Mmol/l ; PO43-: 0,03 Mmol/l ).
Des plaques de colonisation (tuiles c?ramiques) ont ?t? plac?es dans le
syst?me quelques semaines auparavant afin de g?n?rer des surfaces biologiquement
conditionn?es. Les larves d'Acropora florida ont ?t? produites ?
Okinawa, Japon par f?condation externe et ont ?t? envoy?es ? Munich par
courrier a?rien.
Les larves se sont ?tablies sur les tuiles en c?ramique plac?es dans des
bo?tes de Petri. Les polypes juv?niles ont ?t? plac?s dans des bacs de
maintenance sp?ciaux pour le d?veloppement ult?rieur. La survie et la croissance
ont ?t? r?guli?rement mesur?es. ?tonnamment les larves ont surv?cu
? ce voyage mondial du Japon vers l'Allemagne avec un taux proche de 100
%. Bien que le taux de fixation est d?pendant d'une algue coralline sp?cifique
du genre Hydrolithon (Morse et al., 1996) 30,5 % des larves se sont
fix?s en d?pit des conditions li?es ? la captivit?. Au contraire des
larves des incubateurs qui tiennent leurs zooxanthelles des polypes m?res
ceux des esp?ces ? ponte en pleine eau comme A. florida doivent incorporer
ces algues indispensables apr?s la fixation. Il est remarquable que les polypes
juv?niles s'arrangent pour obtenir leurs symbiotes, bien qu'il puisse y avoir
une corr?lation sp?cifique aux esp?ces entre les algues et leur h?te (Rowan
& Powers, 1991). De cette mani?re le recrutement de coraux peut ?tre limit?
par le manque d'algues appropri?es.Sur un total de 420 larves, 99 se sont
?tablies avec succ?s. Au total, 27 colonies ont surv?cu jusqu'? la fin
de l'exp?rimentation apr?s 10 mois. Il est difficile d'estimer le taux de
survie total des ?ufs incluant la p?riode de fixation et celle de recrutement.
On peut suppo- ser que moins d'1/1000 du nombre total d' ?ufs sera f?cond?,
se m?tamorphosera et cro?tra en colonie m?tastable. Dans cette ?tude 16,5
% ont atteint l'?ge de 10 mois (concernant un taux de f?condation de 90
%, Hatta pers cornrn.) Ce r?sultat a ?t? obtenu sans aucune optimisation.
Perspectives futures
D'autres ?tudes vont montrer la praticit? et l'efficacit? r?elle de cette
m?thode. A mon avis trois facteurs sont essentiels pour la reproduction sexu?e
en captivit? des scl?ractiniaires.
1. L'?mission contr?l?e des gam?tes et des planulae
2. Optimisation des conditions d'?tablissement
3. Un taux de survie ?lev? des colonies juv?niles
Des syst?mes d'aquariums sp?ciaux peuvent aider ? renforcer les succ?s
de reproduction. En g?n?ral, les aquariums publics et les institutions scientifiques
ont la possibilit? d'installer des aquariums dans lesquels les coraux peuvent
?tre reproduits dans de bonnes conditions. Dans un futur proche, nous serons
certainement capables de d?terminer les ?v?nements de reproduction m?me
dans des syst?mes clos ind?pendants des conditions naturelles. Dans notre
nouvelle zone de recherche nous projetons d'installer des bacs de reproduction
pour plusieurs esp?ces de scl?ractiniaires. La combinaison des m?thodes
de reproduction sexu?e et asexu?e nous aidera ? obtenir des taux de croissance
important, des quantit?s importantes de nouvelles colonies et de diversit?
g?n?tique.
Ceci ouvrira la porte ? la diminution des r?coltes dans la nature et m?me
plus ? cr?er des programmes de reproduction coordonn?s en faveur des esp?ces
menac?es.
Dirk PETERSEN
Meeres Zentrum Fehrmam
Gertrudenthaler StraBe 12
D-23769 BURG auf FEHRMARN
T?l: 00494371-869763
E-mail: meereszentrum@t-online.de
Internet: www.meereszentrurn-fehrmam.de
| BIBLIOGRAPHIE Adey, W. H. & K. Loveland. 1998. Dynamic aquaria: building living ecosystems. 2nd ed. Academic Press, London Borneman, E. H. & J. Lowrie. 1999. Advances in captive husbandry and propagation: an easily utilized reef replenishment means from the private sector? Proc of the Int Conf on Scientific Aspects of Coral Reef Assessment, Monitoring, and Restoration, Fort Lauderdale: 58 Brockmann, D. 1994. Vermehrung einer Porites-Art im Korallenriff-Aquarium. Das Aquarium 28 (10): 25-29 Fadlallah, Y. H. 1983. Sexual reproduction, development and larval biology in scleractinian corals. A review. Coral Reefs 2: 129-150 Fossa, S. A. & A. J. Nilsen. 1998: Korallenriff-Aquarium. Band 6. Birgit Schmettkamp, Bornheim Green; E. P. and Shirley, F. 1999. The global trade in coral. World Conservation Press, Cambridge, UK. 70 pp. Harrison, P.L. & C.C. Wallace. 1990. Reproduction, dispersaI and recruitment of scleractinian corals. ln: Dubinsky Z. (ed.) Ecosystems of the world. 25. Coral Reefs. Elvesier,Amsterdam, pp. 133-207 Morse, A. N. C., K. Iwao, M. Baba, K. Shimoike, T. Hayashibara and M. Omori. 1996. An ancient chemosensory mechanism brings new life to coral reefs. Biol. Bull. 191: 149-154. Nilsen, A. J. 1998. Mass coral spawning in a captive reef tank. Aquarium Frontiers On-Line, January Petersen, D. 1999a. Sexuelle Planulalarven von Acropora-Korallen. D Aqu u Terr Z (DATZ) 52 (1): 22-26 Petersen, D. 1999b. Die k?nstliche Aufzucht von Korallenlarven zur Rehabilitation geschadigter Korallenriffe und zur Versorgung des internationalen Aquaristik-Marktes. Proc of the 5. Int. Meerwasser-Symposiunl, Bochum: 121-128 Petersen, D. & R. Tollrian. ln press. Methods to enhance sexual recruitment for restoration of damaged reefs. Bul Mar Sci Rowan, R. & D. A. Powers. 1991. Molecular genetic identification of symbiotic dinoflagellates (zooxanthellae). Mar Ecol Prog Ser 71: 65-73 Shlesinger, Y., T. L. Goulet, Y. Loya. 1998. Reproductive patterns of scleractinian corals in the nothern Red Sea. Mar Bio1132: 691-701 Sorokin, Y. 1. 1995. Coral reef ecology. 102. Ecological studies. Springer, Berlin. St?ber, D. 1994. Riffbildende Steinkorallen im Meerwasseraquarium. Stark, Malsch Szmant, A. M. 1986. Reproductive ecology of Caribbean reef corals. Coral Reefs 5: 43-54. Fan, T.- Y., Li, J.-J., Liu, M.-C. & L.-S. Fang. 2000. The application of sexual reproduction to enrich a live coral tank. Proc of the 5th Int Aquarium Congress, Monaco: 41 Tyree, S. 1995. Sexuelle Vermehrung von Pocillopora verrucosa im Aquarium, Teil 2. das Aquarium 29 (3): 28-33 Wallace, C. C. 1985. Reproduction, recruitment and fragmentation in nine sympatric species of the genus Acropora. Mar. Biol. 88: 217-233. |
