





Algues visqueuses : les acteurs de leur formation
Texte: Heinrich H. Barchet *
Quel aquariophile
ne les connait pas, ces "tapis" rouge-brun qui recouvrent tout en
très peu de temps pouvant tout étouffer, ou le voile quise forme
à la surface de l'eau lorsque le brassage est inssufisant ?
Dans ce cas l'aquariophile parle généralement d'algues visqueuses,
bien qu'en ce qui concerne les causes il peut s'agir d'organismes très
divers.
Les algues visqueuses ne constituent pas un groupe uniforme d'organismes,
car parmi leurs causes font partie dasn
l'aquarium aussi bien les diatomées (algues silicieuses) que les cyanobactéries.
Comme autres acteurs apparaissent dans la mer les dinoflagellés appelés
"fleurs de mer" qui apparemment ne jouent pas de rôle important
dans les aquariums.
Une apparition massive d'algues et de cyanobactéries est le plus souvent
restreinte par la limitation d'une substance nutritive nécessaire.
Leur utilisation bloque la croissance, suivie du décès. Hélas
la mort des algues a de nouveau pour effet une libération de substances
nutritives et le cercle diabolique recommence.
 |
| A
cause de la croissance d'algues, les vitres des aquariums sont toujours
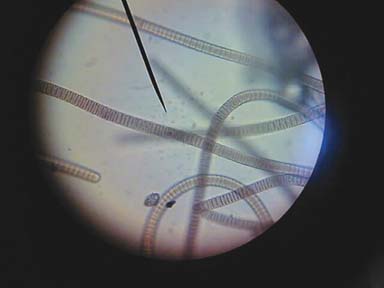
légéèrement brunes. En observant cet Aufwuchs au microscope, on découvre le monde merveilleux des diatomées et des dinoflagellés. Sur l'image, agrandie 400 x, on peut voir quelques Licmophora sp. triangulaires et deux autres diatomées. |
Cependant nous
souhaiterions restreindre ce processus de croissance etd e mort à la
période de démarrage de l'aquarium et ne pas le voir surgir
dans des bacs anciens, rôdés. C'est la raison pour laquelle il
me semble sensé, d'éviter une formation non contrôlée
d'algues visqueuses par une limitation définie des substances nutritives
comme l'azote, les phosphates, le carbone et les silicates, au lieu de les
combattre. C'est pourquoi je ne vais pas dans cet article évoquer les
possibilités d'éradication de cette plaie par les poissons,
les escargots ou les antibiotiques.
D'abord il y a lieu de présenter certains provocateurs liés
au fléau des algues visqueuses.
Diatomées
Les diatomées, dont environ 6000 espèces sont connues de nos
jours, sont les représentants du règne végétal
(Embranchement Heterokontophyta ; Classe : Bacillariophyceae ; Fossa & Nilsen,
1992)
Les diatomées croissent rapidement, leur puissante carapace siliceuse
les protège certes des prédateurs néanmoins elles sont
capables de croquer certains copépodes et autres krills. Il existe
parmi les diatomées certaines espèces qui sécrètent
du poison (par exemple / Pseudonitzche pungens)
Le sicilium (Symbole chimique : Si) est un élément essentiel
pour les algues siliceuses ainsi que pour certains protozoaires (comme les
silicoflagellés) et éponges. La teneur en silicium est très
variable dans diverses espèces d'algues silicieuses. Dans l'eau il
y a également du silicium sous forme d'acide silicique non dissocié
(Si(OH)4) et d'acide silicique simplement dissocié (H+
+ SiO(OH)-3, dont dépend la relation pH (Del
Amo, 1999)
Les diatomées prennent de préférence l'anion SiO(OH)-3
comme source de silicium.
Dans l'eau de mer la concentration en silicium se chiffre de 0,02 à
4 mg/l. Des rapports élevés Si :N et Si :P ont une sélectivité
en faveur de la croissance d'algues siliceuses. S'il se produit une dérive
de Si vers P, suit obligatoirement une dérive des algues siliceuses
vers les flagellés (Egge & Aksnes, 1992)
Les diatomées dans l'aquarium
Les algues siliceuses apparaissent presque toujours dans des aquariums récemment
installés ou après un changement d'eau important. Si dans un
bac il n'y a pas de Si disponible, ceci a pour signification, même en
présence d'autres substances nutritives en quantités suffisantes,
pas de croissance d'algues siliceuses.
L'apport de Si dans l'aquarium se produit par l'intermédiaire de l'eau
de conduite et de mélanges de sel marin contenant du Si. Une élimination
complète d'acide silicique de l'eau de sortie avec une valeur de pH
neutre n'est pas possible avec un échangeur d'ions à lit mélangé
ou d'une installation d'osmose inverse, car plus de 90% de l'acide silicique
existe sous la forme non ionisée et ne peut pour cette raison être
effctivement lié à un échangeur d'ions. En outre cette
forme est capable de traverser partiellement la membrane de l'osmoseur, étant
donné que l'acide silicique non ionisé n'est pas entouré
d'une enveloppe étanche d'hydrates (Bingmann, 2000). Entre temps il
est facile de la retirer de l'eau par liaison avec le matériau absorbant
"Silicarbon" (Fa Aqua Connect).
Si d'un autre côté, il n'y a pas suffisemment de silicium dans
l'aquarium, sa concentration peut être augmentée par addition
de métasilicate de sodium (Na2SiO3 x 9 H2O)
à l'eau de sortie.
La teneur en acide silicique de l'eau peut être déterminée
avec le test Merck Aquaplant silicium 14410. Les indications de concentration
sont données comme SiO2.
 |
| .En observant des algues visqueuses au microscope, on peut reconnaitre de fin cordons d'algues, maintenus ensemble par une couche de mucus. |
Cyanobactéries
(Algues bleues)
De nombreux aquariopjhiles ont fait l'expérience selon laquelle durant
la phase de démarrage de l'aquarium les algues siliceuses soient suivies
par les cyanobactéries. Les cyanobactéries (= algues bleues)
font partie de l'embranchement Cyanophyta. Ce n'est qu'en 1978 que le scientifique
canadien Roger Stanier a introduit la notion de cyanobactéries. Mondialement
plus de 2000 espèces sont connues, existant dans tous les biotopes
du globe (terrestres, d'eau douce et marins) Elles se reproduisent par une
simple division cellulaire. Les fossiles les plus anciens connus actuellement
sont représentés par les cyanobactéries. Ainsi on les
a trouvées dans des pierres africaines comme fossiles datant du Protéozoïque
(période allant de - 2,5 milliards à environ 540 millions d'années)
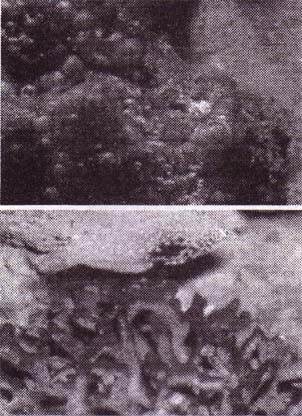 |
| Les
cyanobactéries dans l'aquarium. La forme du haut apparaît
presque toujours lors de la phase de démarrage d'un aquarium, disparaît
rapidement de nouveau.Les masses d'algues muqueuses sont pleines de bulles
d'oxygène. L'oxygène provient des algues. Bas : De telles algues visqueuses rouges appelées "fléau rouge", peuvent faire une apparition subite. Elles sont très difficiles à éliminer de l'aquarium.. |
Les cyanobactéries
possèdent le même appareil photosynthétique que les plantes.
Elles contiennet de la Chlorophylle A et les mêmes substances colorantes
d'accompagnement (phycobilline et carotène) comme elles existent chez
les plantes supérieures, les qlgues et les micro-organismes. Ainsi
elles peuvent s'adapter à n'importe quel type d'éclairage et
surpassent les algues en ce qui concerne le rendement photosynthétique
et la capacité d'adaptation à diverses conditions de lumière.
Quelques cyanobactéries possèdent la capacité d'utiliser
pour leur croissance l'azote dissous dans l'eau (N2) à la
place des liaisons azotées dissoutes dans l'eau en quantité
limitée. En outres elles ont besoin de phosphates, qui régularise
la capacité de fixationde l'azote. La transformation de N2
en ions ammonium NH+4 se produit dans des cellules spécialisées,
appelées hétérocystes.
Des eaux agitées réduisent fortement leur taux de reproduction,
car les cyanobactéries ne peuvent pas fixer efficacement l'azote dans
une eau agitée. En outre elles sont dans l'obligation de cropitre en
colonies car la structure en colonie est importante pour protéger le
processus biochimique de fixation de l'azote face à l'oxugène.
Une importante enzyme clé pour ce processus est la nitrogénase,
qui est extrèmement sensible à l'oxygène. Ainsi certains
organismes fixateurs de l'azote sont anaérobes stricts. 50% de l'azote
nouvellement formé dans la mer a son origine dans la fixation de l'azote
des cyanobactéries. A ce propos les Trichodesmium spp. sont les plus
importants fixateurs d'azote dans la mer (présents partout à
la fois).
Symbiose
Souvent les cyanobactéries forment des symbioses avec d'autres plantes.
Plusieurs genres de cyanobactéries vivent avec des champignons. Ainsi
que les recherches d'Unson et Al., 1994 l'ont montré, on peut en déduire
que les cyanobactéries symbiotiques participent à la production
de substances secondaires des invertébrés marins. Jusqu'à
présent nous n'avons pas réussi à isoler et à
cultiver des cyanobactéries symbiotiques à partir d'invertébrés
marins.
Certaines diatomées marines peuvent vivre en symbiose de manière
facultative avec des cyanobactéries filamenteuses. Là aussi
le symbiote est intégré dans le plasma de la cellule hôte.
Hélas, je n'ai pas trouvé d'indice dans la littérature
à propos de l'existence de telles communautés de vies dans les
aquariums marins et si elles y jouent un rôle.
Les cyanobactéries
produisent leur nourriture elles-mêmes
Les cyanobactéries participent à l'auto-épuration des
mers. Elles décomposent des substances extrêmement toxiques comme
l'hydrogène sulfuré ou de nombreuses liaisons pétrolifères
et apportent au biotope l'indispensable oxygène. Les cyanobactéries
sont également très importantes dans les champs de riz tropicaux
et subtropicaux où elles contribuent à la disponibilité
de l'azote. Dans le champs de riz on cultive des fougères aquatiques
du genre Azolla qui vivent symbiotiquement avec des cyanobactéries
fixatrices de l'azote. Les fougères sécrètent l'ammonium
excédentaire, augmentant ainsi la teneur en azote de l'eau et du sol
et produisant une augmentation de rendement de la récolte de riz. D'intéressante
manière les nitrates inhibent la fixation de N2 chez les
bactéries bulbeuses à partir de concentration de 3 à
10 µmol. Je n'ai pas pu déterminer si la liaison azotée
est également inhibée chez les cyanobactéries par des
valeurs en nitrates correspondantes. je serais reconnaissant pour des informations
correspondantes.
|
Quelles
différences sont sélectives dans la cinétique de
la limitation des substances nutritives et celle de la réception
des substances nutritives pour les :
|
||||
|
Diatomées
|
Non
diatomées
|
Cyanobactéries
|
Bactéries
communes
|
Flagellés
|
| Teneurs
élevées Si :N Si :P |
Teneurs
élevées N:P |
Valeurs
basses N : P |
Dérive de Si : P | |
| Si est essentiel pour la croissance et la multiplication | En présence de concentrations importantes de substances nutritives absorption plus rapide que les concurrents | Fixation et stockage N2 | Surpassent d'autres organismes lors de concentrations de substances nutritives basses | Les flagellés hétro- et mixotrophes mangent les bactéries indépendantes |
| Peuvent stocker de l'azote | Peuvent stocker N + P pour environ 3 divisions cellulaires. Elles sont donc autarciques de la concentration actuelle en substances nutritives pour plusieures générations. | Nécessitent la vitamine B12 comme facteur de croissance ; C limite. | C limite | Nécessitent la vitamine B12 comme facteur de croissance |
Fleurs de
mers
Les phénomènes d'explosion d'algues, qui peuvent s'étendre
dans les mers tropicales sur une longueur de 10 à 100 kilomètres,
peuvent apparaître dans la nature en l'espace de quelques jours puis
de nouveau disparaître (Richardson, 1997 ; Carpentier & Montoya,
1999) parmi les cyanobactéries seules les espèces des genres
Aphanizomenon, Nodularia, Richelia et Trichodesmium
erythraeum est la cause de la coloration rouge de la Mer Rouge (Capone
& Subrama-Niam, 1988 ; Capone & Zehr, 1997)
Trichodesmium, des dinoflagellés précis, Cochlodinum
et des diatomées formant des chaînes apparaissent dans les fleurs
des mers comme monoculture tandis que d'autres dinoflagellés peuvent
être associés avec des cultures de diatomées melangées.
Entre temps la preuve a pu être apportée que Trichodesmium
stimule la croissance de Gymmodinium (Magniem, 2000) Ce faisant Gymmodinium
utilise l'azote libéré par Trichodesmium erythraeum.
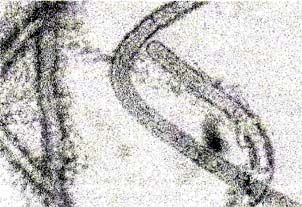 |
| Cette algue bleue, qui ressemble beaucoup à une espèce d'Oscillatoria, a été trouvée sur le tronc d'un corail mou Sarcophyron. Elle s'y est développée sous la forme bleu foncé, filamenteuse (agrandissement 800 x) |
Formation
des toxines
Quelques espèces de cyanobactéries comme Microcystis anabaena
et Aphanizomenon flosaquae sont toxiques (Carmichael & Mahmood,
1990) Elles sont par exemple responsables de l'apparition d'empoisonnements
massifs chez les oiseaux aquatiques ets les poissons. En ce qui concerne les
poisons les plus puissants pour l'homme et l'animal, il s'agit de poisons
agissant sur les nerfs et le foie.
Apparition en aquarium
En plus des cyanobactéries appraissant sous forme de tapis lors de
mauvaises conditions environnementales sur la décoration et le sol,
certaines espèces croissent comme parasites dans le squelette calcaire
des madrépores (par exemple Phormidium corallyticum comme cause
de la maladie de la bande noire ; Fossa & Nilsen, 1992 ; brockmann, 2000)
ou vivent en symbiose avec les éponges.
Spirulina
Pour terminer ce paragraphe, j'aimerais encore présenter un représentant
des cyanobactéries que la plupart des aquariophiles marins connaissent
: Spirulina. Spirulina ne vit ni dans la mer ni dans l'eau douce.
Elle est plutôt localisée dans les lacs salés fortement
alcalins d'Europe centrale et d'Afrique orientale. Spirulina ne produit pas
de toxines elle-même. Cependant des contaminations avec des cyanobactéries
productrices de toxines sont concevables, qui toutefois peuvent être
empêchées par des conditions de culture correspondantes. Les
conditions optimales pour la croissance de Spirulina sont : pH : 10,2 à
11,3 ; température : 35 à 37 °C (avec une température
de l'eau de 20 ° C la croissance s'arrête) ; densité de l'eau
à 20 °C : concentration en sel entre 20 et 70 g/l, la tolérance
allant de 1 à 270 g/l. Une miltiplication de Spirulina ne se
produit pas en aquarium.
Spirulina a déjà servi pour l'alimentation humaine il
y a plusieurs siècles, durant la période aztèque. De
nos jours elle remplit encore cette mission au Tchad, Afrique centrale. Ces
cyanobactéries constituent aussi la nourriture principale des flamands
de Lesser en Afrique orientale. En aquariophilie marine Spirulina représente
une nourriture d'appoint prisée par de nombreux poissons. Des différentes
espèces de Spirulina seules quelques-unes sont utilisées
commercialement, entre autres Spirulina maxima et Spirulina platensis.
Elles possèdent une importante quantité de vitamines (par exemple
B12), du fer organique chélaté et des protéines.
La Spirulina sous forme de produit séché ne doit pas présenter
de couleur bleuâtre. Cette coloration signale un séchage incorrect
et donc une destruction de la chlorophylle.
 |
| Haut
: ici Derbesia pousse sur un sol sablonneux dans une petite lagune près
de l'Île Kuredu, Maldives Bas : bryopsis sur une pierre vivante dans l'aquarium. Les thalles pennés sont typiques de cette algue filamenteuse. |
Dinoflagellés
Les dinoflagellés flottant fon partie dans l'aquarium des ennemis des
diatomées et des cyanobactéries. Dans l'aquarium on trouve Gamberdiscus
toxicus (Delbeek & Sprung, 1994), qui produit différentes toxines
comme la caritoxine et la maitotoxine et qui peut être responsable dans
la mer de la "marée rouge". Font également partie
de ce groupe les parasites piscicoles comme Amyloodinium ocellatum
et Cryptocaryon irritans, qui sont connus de tout amateur de poissons.
Algues
Les algues ont des rapports plus importants C : P que les bactéries.
Contrairement aux bactéries les plus grandes algues peuvent stocker
les liaisons phosphatées et azotées pour environ trois divisions
cellulaires. Elles sont ainsi indépendantes durant plusieurs générations
d'un approvisionnement actuel des substances nutritives. Ceci explique pourquoi
les algues filamenteuses réagissent si péniblement à
une réduction des concentrations en substances nutritives? se traînant
dans le temps.
Substances nutritives
la croissance de phytoplancton est limitée dans l'aquarium et dans
la mer par les substances nutritives. Afin de comprendre cette notion, il
faut savoir que les algues nécessitent des substances nutritives en
proportions relativement fixes pour la croissance t la multiplication. Ceci
signifie qu'elles ont plus besoin d'une substance et moins d'une autre (Gotham
& Rhee, 1981)
dans les plantes il existe un rapport molaire entre l'azote et le phosphore
(cette proportion est appelée ratio de Redfield) de 15 : 1, le phosphore
constitue la substance nutritive limitante, ce qui signifie que les algues
peuvent s'approvisionner avec autant d'azote qu'elles ont besoin. Par rapport
à l'azote, le phosphore disponible en moindre quantité sera
utilisé avant l'azote et constitue ainsi le facteur limitant.
Pour le phytoplancton marin le ratio de Redfield C : N : P est de 106 : 16
: 1 (avec C = carbone, N = Azote, P = phosphore ; Redfield , 1963) Des variations
de ce proportions de substances nutritives les unes par rapport aux autres
ménent entre autre à des dérives dans la composition
des espèces du phytoplancton et ont une influence sur l'issue de la
concurrence interspécifique. Autrement dit, le ratio de Redfield détermine
quelle espèce domine en fonction des proportions de substances nutritives.
Résumé
Etant donné que les sources d'algues visqueuses peuvent s'adapter à
différentes couleurs de lumière, elles surpassent les algues
supérieures en ce qui concerne la photosynthèse. C'est la raison
pour laquelle lors de l'apparition d'algues visqueuses il faut en priorité
vérifier l'état du système d'éclairage (par le
vieillissement de la source lumineuse dérive limitée du spectre
ou une part générale trop élevée de jaune/vert
; Hüster, 1985 ; Wilkens, 1985)
D'autres part la formation d'un voile superficiel doit être évitée
par un puissant brassage. Ceci empêche également la formation
de gradients de concentrations de substances nutritives telle que la fixation
de N2 par les cyanobactéries. Un brassage puissant de l'eau
ssemble en général limiter une multiplication massive des cyanobactéries
fixatrices de N2.
Par une délimitation définie des substances nutritives doit
être maintenue une croissance concurrentielle en micro-vie dans l'aquarium.
Les diatomées en font partie, qui dans une taille de population visible
doivent être tolérées comme adversaires (concurrents alimentaires)
aux cyanobactéries et flagellés dans l'aquarium. Leur taux de
multiplication peut être contrôlé sans problème
par l'intermédiaire de la concentration en Si. les diatomées
peuvent être maintenues sous contrôle au moyen d'organismes herbivores
et d'un aimant pour nettoyer les vitres. Les diatomées consomment de
l'azote (nitrates), des phosphates et d'autres substances nutritives et constituent
ainsi elles-mêmes une nourriture idéale pour de nombreux organismes
marins dans nos aquariums (Bingman, 2000 ; Fossa & Nilsen, 2001)
Litt?rature
BINGMAN, C. (2000) : Silicon - Foe or friend ? Aquarium
Frontiers Feature. On-Line Magazine:http://members.home.net/kevdone/AF/Articles.html
BROCKMANN, D. (2000) : Fische und Korallen im Meer und im Aquarium.
Birgit Schmettkamp Verlag, Bornheim.
CAPONE, D.G. & A. SUBRAMANIAM (1988) : An extensive bloom of the N2
fixing cyanobacterium Trichodesmium erythraeum in the Central Arabian sea.
Mar. Ecol. Prog. Ser 172 :281-292
CARMICHAEL, W. W. & N. A. MAHMOOD (1990): Natural toxins from cyanobacteria.
In: Marine Toxins (S. HALL & G. STRICHARTZ, eds.), ACS Symposium Series
418, p.87
CARPENTER, E. J. a J. P. MONTOYA (1999) : Extensive bloom of a N2
fixing diatom/cyanobacterial association i the tropical Atlantic ocean
Mar.Ecol.Prog.Ser. 185 : 273-283.
DEL AMO, Y. (1999) : Determination of the chemical form of dissolved Si
taken up by diatoms. University of California. Santa Marine Science Institute.
DELBEEK, J. C. & SPRUNG J. (1994) : Dass Riffaquarium, Bd 1, Ricordea
Publishing, Coconut Grove, Florida, USA.
EGGE, J. K. & D. L. AKSNES (1992) : Silicate as regulating nutrient
in phytoplankton competition. Mar.Ecol.Ser. 83 : 281-289.
FOSSA, S. A. & A. J. NILSEN (1992) : Korallenriff-Aquarium, Bd 2. Birgit
Schmettkamp Verlag, Bornheim.
FOSSA, S. A. & A. J. NILSEN (1992) : Korallenriff-Aquarium, Bd 1 - 4.
auflage. Birgit Schmettkamp Verlag, Bornheim.
GOTHAM, I. J. & G. Y. RHEE (1981) : Comparative kinetic studies of
phosphate limited growth and phosphate uptake in phytoplankton in continuous
culture. J. Physiol. 17 : 257-265.
HÜSTER, R. (1985) : Rotalgen im Seewasser. Das Aquarium 188
: 81-82
MAGNIEN, R. (2000) : Harmful algal blooms : Worldwide problem creeps into
Bay. Bay Journal 10.
MATERASS, R., M; TREDECI & W. BALLONI (1984) : Spirulina culture in
sea water. Appl.Microbol.Biotech. 19 : 384-386
REDFIELD, B. K. & F; RICHARDS (1963) : The influence of organisms on
the composition of sea water, In : Interscience (M. N. HILL, ed.), New
York, pp. 26-77
RICHARDSON, K. (1997) : Harmful or Exceptional Phytoplankton Blooms in
the Marine ecosystem. Adv Mar.Biol. 31 : 301-385.
UNSON, M. D., N. D. HOLLAND & D. J. FAULKNER (1994) : Marine biology.
WILKENS, P (1985) : Rotalgen im Seewasser. Das Aquarium 194
: 423/927 - 424/928
Avec
l'aimable autorisation de M; Heinrich Barchet et du Birgit Schmettkamp Verlag.
Adaptation J.J. Eckert
Les textes et photos restent la propriété des auteurs.
